自動車の電動化は一時ほどの勢いはなくなりましたが、将来的には電動化の方向性はゆるぎないと思われます。燃料電池自動車も少しずつ身近なものとなってきました。路線バスにも燃料電池で走るものも時々見られます(図1)。自動車用の燃料電池は水素と空気中の酸素の反応を利用するもので、その構造と原理を図1に示しました。水素と酸素の反応のエネルギーを電力として取り出すことになります。このような原理にもとづくので、二酸化炭素を出さず、水しか排出しないクリーンな動力とされています(ただし、現在水素は化石燃料から二酸化炭素の排出を伴って製造されているので、必ずしもクリーンではありませんが)。
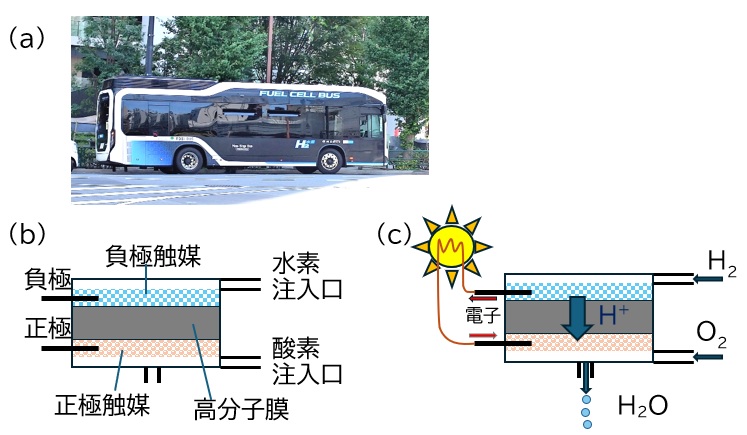
図1 (a) 燃料電池で走る東京都営路線バス (b) 燃料電池の構造概略図
(c) 燃料電池の作動時の物質の動き。負極触媒上では水素から電子が放出され水素イオンH+が発生する。水素イオンは高分子膜を通り正極触媒上で酸素と電子と反応して水が生成し、その水は電池外に排出される。
この燃料電池に代わる様々なタイプの電池も研究されています。例えば図2に示したのはリチウム−空気電池で、水素の代わりにリチウムを使うものです[1]。この電池は二次電池(充電ができる)としての研究がなされていますが、現在よく使われているリチウムイオン電池とは全く異なり、エネルギー密度(単位重量当たり取り出せるエネルギーの大きさ)がリチウムイオン電池よりもはるかに大きいのが特徴です。残念ながら現在のところまだ充放電の繰り返し回数が少ないなどの問題点があるようです。
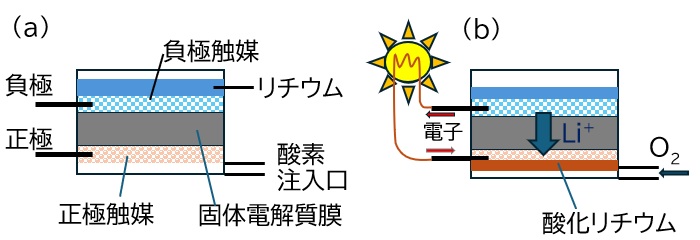
図2 (a)リチウム−空気電池の構造概略図
(b) 作動時の物質の動き 負極触媒上ではリチウムがリチウムイオンLi+となり、電子が放出される。リチウムイオンは固体電解質膜を通り正極触媒上で酸素と電子と反応し、酸化リチウムが生成する。
リチウムの代わりにナトリウムを使ったらどうなるかということは、化学者なら誰でも考えることでしょう。ナトリウム−空気電池も研究されています。しかし、取り出せるエネルギーや電流面積密度(電極面積あたり取り出せる電流)など電池としての性能はまだ満足できるものではありませんでした。ごく最近、MIT(マサチューセッツ工科大学)のY.-M. Chiang教授らは、充電して使うことは考えずに一次電池としての利用を想定して、新しいタイプのナトリウム-空気電池を開発しました[2]。
この電池の構造と動作の原理を図3に示します。ナトリウムは96℃で溶融するので、この電池は110℃程度の温度で動作させます。負極と正極の電極触媒には燃料電池用に市販されているものが使われています。また、固体電解質膜には多孔性のセラミックスが用いられており、この材料はナトリウムイオンを素早く通すことができるとのことです。今回の研究では正極に純粋な酸素を通すのではなく、水分を含む酸素を通したことが面白い成果の鍵となりました。電池として使用していくと正極には酸化ナトリウムができますが、これが反応の進行を妨げることが従来問題でした。しかし水分があるとこれが反応して水酸化ナトリウムNaOHとなります。NaOHは潮解性が高く、水分を含む気流中ではすぐに溶液となります。これが電池の下部にたまり、電池から排出されていくことで、電池の性能が低下しないということが分かりました。
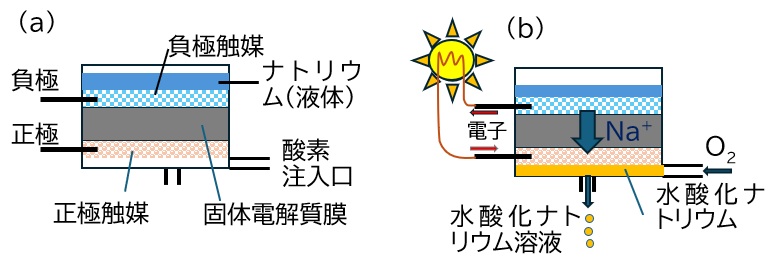
図3 (a) ナトリウム−空気電池の構造概略図
(b) 作動時の物質の動き リチウム-酸素電池と同様に、負極触媒上ではナトリウムが陽イオンNa+となり、電子が放出される。ナトリウムイオンは固体電解質膜を通り正極触媒上で酸素と電子と反応し、さらに水と反応することで水酸化ナトリウム溶液となる。
この電池は、従来のリチウム−空気電池やナトリウム−空気電池に比べて、非常に高い電流密度と高いエネルギー密度を達成することができました。エネルギー密度は理論上3.6 kWh/kg(ナトリウム重量あたり)、モーターの効率などを考えると2.1 kWh/kgとなるそうです。特に液体のナトリウムを使うことで多量のナトリウムを連続して反応させることができ、また生成物を電池外に排出することによって、長時間の使用でも電池の性能が低下せずに多くのエネルギーを取り出せることになったのです。
Chiang教授らは、航空機や船舶、貨物列車など輸送機関での応用を念頭に置いています。例えば70人乗りの比較的小型の短距離旅客機を考えると、200マイル(360 km)の運行に2.6 MWhのエネルギーが必要で、前述の数値から計算すると今回の電池では1200 kgのナトリウムを燃料として積み混むことになります。現在ナトリウムの価格を見積もると、同じエネルギーを得るのに必要な燃料のコストは現在のジェット燃料の2倍程度になると研究者らは推定しています。ただ、この電池を使用すると水酸化ナトリウムが生成します。航空機の場合これをなんと空中に放出するというのです。それによって水酸化ナトリウムが空気中の二酸化炭素と反応して炭酸水素ナトリウムができます(図4)。その結果、上述の飛行1回で2300 kgの二酸化炭素を固定できます。
NaOH + CO2 → NaHCO3
この反応が起こることで、現在問題となっている二酸化炭素濃度を減らすことができるというのです。二酸化炭素の排出権取引を考慮すると、上述の運行コストをさらに下げることができると論文では指摘されています。
ナトリウムは非常に発火しやすく、ジェット燃料以上に危険な物質です。このような電池の実用化には安全性が極めて重視されるでしょう。しかし現在すでに溶融ナトリウムと硫黄を用いた電池はNAS電池[3]として、電力貯蔵などに実用化されています。水酸化ナトリウム溶液を直接航空機から排出するというのも乱暴にも見えますが、様々な知恵を皆で考えることは重要ではないでしょうか。それではまた次回。
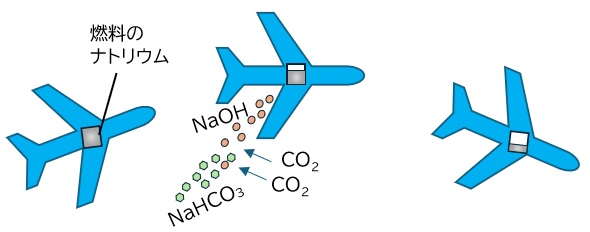
図4 今回開発されたナトリウム−空気電池をつかった電動航空機の運航イメージ図。燃料としてのナトリウムを積み込んだ航空機が運航すると、水酸化ナトリウム溶液(図ではオレンジ色粒子)が排出されるが、二酸化炭素と反応して炭酸水素ナトリウム(緑色粒子)となって二酸化炭素が固定される。
[1] 産業技術総合研究所、記事 “新しい構造の高性能「リチウム-空気電池」を開発”
https://www.aist.go.jp/aist_j/press_release/pr2009/pr20090224/pr20090224.html
2025年7月1日閲覧
[2] K. Sugano, S. Mair, S. Ganti-Agrawal, A. S. Friesen, K. Raman, W. H. Woodford, S. Sripad, V. Viswanathan and Y.-M. Chiang, Joule, DOI:10.1016/j.joule.2025.101962.
[3] NAS電池は日本ガイシ(株)の登録商標。
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 炭素の新しい同素体:C48 - 2026年1月20日
- 2025年 ノーベル化学賞:3次元空間を自在にデザイン。空孔をもつ錯体化合物 - 2025年12月3日
- 火星で生命の痕跡か - 2025年11月3日