こんにちは。皆さんよくご存じの通り、同素体というのは、1種類の元素からできている物質(単体)で構造や性質が異なるものをいいます。例えば炭素ではダイヤモンドや黒鉛のほかにも、サッカーボール型の分子であるC60などが知られていますし、酸素には空気中に含まれるO2以外にオゾンO3がよく知られています(図1)。しかし窒素はどうでしょうか。窒素はN2分子の形で空気中に約80%含まれ、生物の営みにも重要な元素です(記事1、記事2)。しかしN2以外の同素体について聞いたことはないと思います。窒素の同素体については以前から多くの方が研究に取り組んできましたが、実際にN2以外の分子を得て構造を明らかにした研究はありませんでした。窒素原子のみからなるイオンは昔から知られていますが、中性の分子は知られていません。また、炭素からなるダイヤモンドのように、分子ではなく窒素原子のみからなる固体については、実際に超高温、超高圧(2000K、110GPa)の条件で存在するということは2004年に報告されました[1]。この条件下では各窒素原子には3つの窒素原子が結合して立体的に窒素原子が単結合によって結合した構造の固体を形作っています。
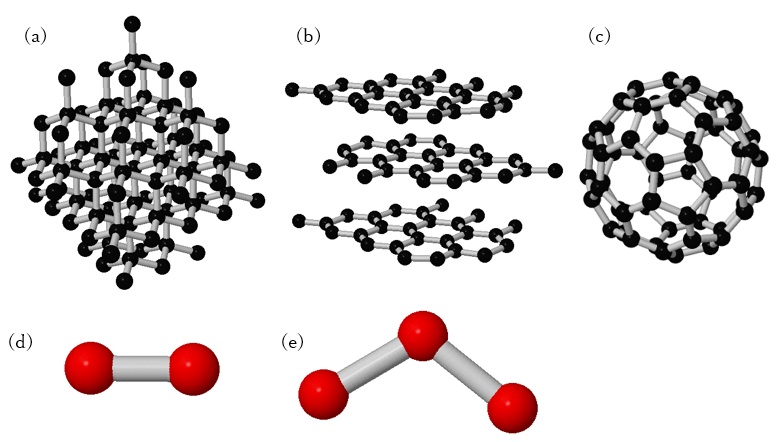 図1 炭素と酸素の同素体。(a) ダイヤモンド。 (b) 黒鉛。 (c) C60。
図1 炭素と酸素の同素体。(a) ダイヤモンド。 (b) 黒鉛。 (c) C60。
(d) 酸素。 (e) オゾン。
理論上は図2のようなN4、N6、N8などの分子の可能性が以前から考えられてきました[2]。N4は長方形や正四面体、N6はベンゼンのような正六角形やジグザグ型の分子、そしてN8は立方体の形が提案されました。しかしどれも非常に不安定とされ、実際に合成されたことはありません。2002年にN4分子が作られ、1μ秒以上の寿命を持っているという報告がなされました[3]が、構造は不明で、極めて不安定な分子であることには違いありません。
今回ドイツの研究者たちは、N6分子を実際に合成し、それを低温で分析して構造を明らかにしました[4]。研究者たちは室温で窒素原子を含む銀の化合物から新しい窒素単体を作りだし、それを極低温(10K)の固体アルゴン中(アルゴンは84K以下で固体となります)で捕まえるという方法でN6が得られることを明らかにしました。
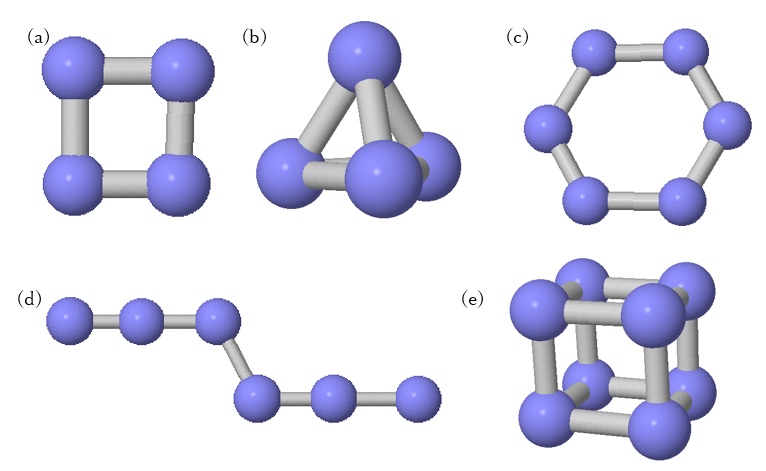 図2 これまで理論的に考えられてきた窒素の同素体。 (a) 長方形N4
図2 これまで理論的に考えられてきた窒素の同素体。 (a) 長方形N4
(b) 正四面体N4 (c) 正六角形N6 (d) ジグザグ型N6 (e) 立方体N8
こうして得られたN6分子の構造は、主に赤外線を使った分析方法によって調べられました。分子はその構造によって特定の波長の赤外線を吸収します。どの波長を吸収するかを調べた結果の図を赤外吸収スペクトルといいます。そのスペクトルから、多くの分子の構造を推定することができるのです。また同じ組成N6でも、六角形とジグザグ型ではその対称性が異なります。赤外吸収スペクトルは対称性によってもその結果が大きく異なるので、分子の形の推定にも威力を発揮します。今回、研究者たちは通常の窒素原子(14N)を含むN6分子だけでなく、同位体(15N)を含む分子の研究も行い、その結果図2(d)のようなジグザグ型の分子であることを確かめました。この分子は室温では速やかにN2に分解してしまうのですが、10Kのみならず液体窒素温度(77K)でもフィルム状の固体として安定に存在し、スペクトルを観測することもできました。
さらに非常に精度の高い量子力学計算によってこの分子の構造や性質が検討されました。その結果明らかになったことを図3に示します。各原子間の距離は図に示すとおりで、中央の窒素原子間の距離は他の原子間距離に比べて長くなっています。このことから中央の窒素原子間の結合が単結合で、それ以外は単結合と二重結合の間くらいの結合であるとされました。図で原子間が実線と点線で表されていますがこれはその結果を示しています。よって単純に考えれば中央の窒素原子間の結合が最も弱く、このN6分子が分解するならば、まずその結合が切れると考えるのが自然な考え方と思うのですが、原子間の切断に必要な活性化エネルギーを計算すると中央の結合を切るには26.1 kcal/molのエネルギーが必要なのに対して、端から2番目と3番目の窒素原子間の結合を切るには14.8 kcal/molですむと言うことが分かりました。そのため、室温程度では図3下の赤線の部分で結合が切れてN2分子になってしまうのです。ただ、以前研究された正六角形型のN6分子では結合が切れるための活性化エネルギーはたったの4.2 kcal/molと計算されていて、それに比べると今回の分子はかなり安定であることが分かります。
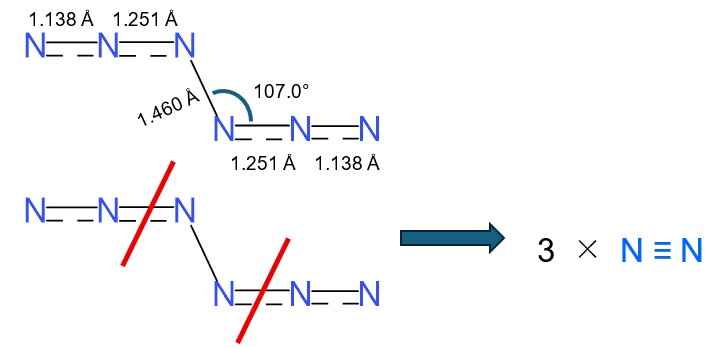 図3 (上) 今回得られたN6分子の構造、原子間距離や角度。
図3 (上) 今回得られたN6分子の構造、原子間距離や角度。
(下) N6分子が分解する際には赤線部分が切断されてN2が3分子生成する。
今回作られたN6分子は、3つのN2分子に分解する反応の反応熱は185 kcal/molと計算されていて、これは単なる分解反応の反応熱としてはかなり大きな値であり、著者らは将来のエネルギー貯蔵物質としての新たな可能性を拓くものだとしています。今回得られたN6分子は、窒素の同素体分子としてはこれまで思われていた以上に安定であることが分かりました。とはいっても低温でないと存在できないようでは、実用になるものではありません。しかし、単純な構造でありながらまだまだ思いがけない物質がありうるということをこの研究は示しているように思われます。化学はやはり奥が深いですね。それではまた次回。
[1] M. I. Eremets, A. G. Gavriliuk, I. A. Trojan, D. A. Dzivenko and R. Boehler, Nature Mater, 2004, 3, 558–563. https://www.nature.com/articles/nmat1146
[2] (i) W. J. Lauderdale, J. F. Stanton and R. J. Bartlett, J. Phys. Chem. 1992, 96, 3, 1173–1178. https://pubs.acs.org/doi/pdf/10.1021/j100182a029、(ii) M. Bittererová, H. Östmark and T. Brinck, Chem. Phys. Lett., 2001, 347, 220–228.
https://www.sciencedirect.com/science/article/abs/pii/S0009261401010028
[3] F. Cacace, G. de Petris, and A. Troiani, Science 2002, 295 480-481. https://www.science.org/doi/10.1126/science.1067681.
[4] W. Qian, A. Mardyukov and P. R. Schreiner, Nature, 2025, 642, 356–360. https://www.nature.com/articles/s41586-025-09032-9
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 炭素の新しい同素体:C48 - 2026年1月20日
- 2025年 ノーベル化学賞:3次元空間を自在にデザイン。空孔をもつ錯体化合物 - 2025年12月3日
- 火星で生命の痕跡か - 2025年11月3日