| プラセオジム(59Pr)の単体は銀白色の金属(25℃での密度6.8g/㎤,融点931℃,沸点3512℃)です。スウェーデンの化学者C.モサンデルは,プラセオジムとネオジム(60Nd)を新元素と考え,その性質がランタン(57La)と双子のように類似で共存していることから,ギリシア語の「双子」からジジムと名付けました。 |
双子の元素「ジジム」
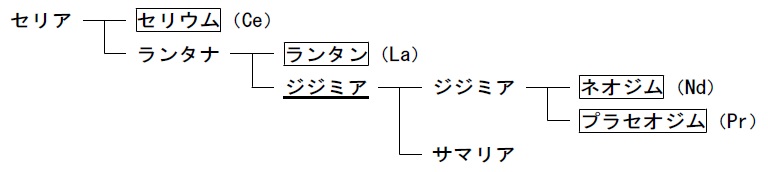
1803年,スウェーデンの化学者J.ベルセリウスとW.ヒシンイェルは,それぞれ独立にセリア(セリウムの酸化物)を発見しました。ベルセリウスの助手の一人であったC.モサンデルは,1839年,セリアからランタナ(ランタンの酸化物)を分離し,「隠れている,気付かずにいる」という意味のギリシア語λανθανωからLanthanaと名付けました。
このときモサンデルは,セリウム塩を塩素で酸化し,酸化セリウム(Ⅳ)(CeO2)として沈澱させてセリウムを除きました。セリウムが二つの酸化数をとることは当時既知であり,モサンデルが行った操作はセリウムを他の稀土類元素から分離する有効な方法でした。
モサンデルは更に,1841年,ランタナを稀硝酸で処理してバラ色の物質(次の図で下線のあるジジミア)を分離し,これを新元素の酸化物と考えて,ランタナとは分かち難く双子のような関係にあることから,ギリシア語のδιδυμος(双子)に基づいてジジム(didymium,元素記号はDi)と名付けました。モサンデルは,ランタンとジジムの分離には硫酸塩の分別結晶法が適することを見出しました。稀土類硫酸塩の溶解度は温度の上昇に伴って減少するので,硫酸塩の氷冷水飽和溶液の温度を徐々に上げていくと,溶解度の小さいものから順に晶出します。
ところで,ジジムという元素名に関して,ドイツのF.ヴェーラーは,響きが子どもっぽいなどと指摘しました。これに対してベルセリウスは,次のように述べてモサンデルを擁護し,逆に,響きが良くないのに既に使われている有機化合物名を列挙しています。
-“いいえ,親愛なる友人よ,私はこの名前が気に入っているわけではありませんが,この名前を変更するようモサンデルに頼もうとは思いませんし,できません。(中略)彼はこの土(新元素)には他の金属と異なった符号になるように,敢えてDの頭文字の名を付けようとしています。事実あなたの言われるように,同じ子音やほとんど同じ母音の響きの繰り返しは耳障りであることは確かです。しかし,やがて人々もその音に慣れるでしょうし我慢できるようになると思います。そしてあなたも同じようになるに違いありません。”
ジジムがかつて元素であると考えられていたことの名残は「ジジム化合物」などの用語にも見られます。ジジムの主な用途はガラスの添加剤で,ジジムガラスは,熔接などの高温融解物などを扱う際の保護メガネとして利用されてきました。ジジムガラスは,ネオジムの作用で淡青紫色をしており,波長590㎚の光を吸収することから,炎光分析では,ナトリウムD線を除去するフィルターや分光光度計の波長校正用のフィルターとしても使われます。

ジジムガラスのメガネ
出典:Карма2による”Didymium Glasses Black Wrap Frame”ライセンスはCC BY-SA 4.0(WIKIMEDIA COMMONSより)
〝緑の〟ジジミアと〝新たな〟ジジミア
スイスのJ.マリニャクやフランスのP.ボアボードランらは,ジジミア(ジジムの酸化物,前図で下線がない方のジジミア)がなおも複数の酸化物の混合物であると確信していたものの,それらを分離することは叶いませんでした。なお,サマリアの分離についてサマリウムの回もお読みください。(⇒ココをクリック)
1882年,プラハ大学のB.ブラウナーは,ジジミアを分光器で調べ,青色域(449~443㎚)と黄色域(590~568㎚)に一群の吸収帯を発見しました。これを受けてオーストリアの化学者ヴェルスバッハ(C.アウエル)は,1885年,ジジムの硝酸アンモニウムとの複塩の分別結晶を繰り返し行ってプラセオジミア(緑のジジミア)とネオジミア(新たなジジミア)の存在を確定したのです。
酸化プラセオジム(Ⅲ)(Pr2O3)はガラスの着色剤や陶磁器用の黄色釉薬,セラミックスコンデンサー用の材料として使われています。酸化ネオジム(Ⅲ)(Nd2O3)はハイパワーレーザー発振用のガラス素材として有用で,鉄やホウ素との合金として高性能の永久磁石にも使われています。(⇒プラセオジムによる着色についてはココをクリック)
 プラセオジム化合物の釉薬(左)と焼成後のタイル(右)
プラセオジム化合物の釉薬(左)と焼成後のタイル(右)
(愛知県常滑市・INAXライブミュージアム,令和4年7月・撮影)
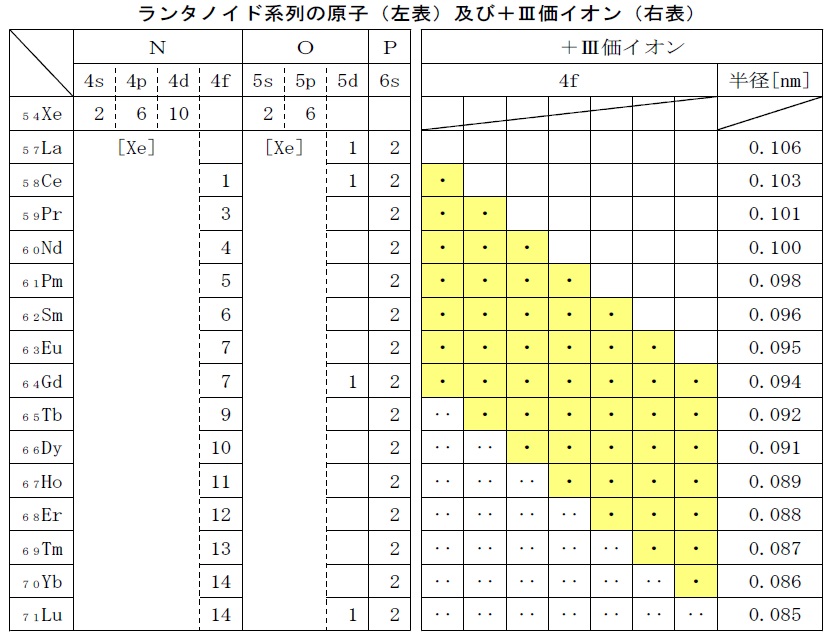
稀土類元素の性質と電子配置
ランタノイドの電子配置は,4f軌道(N殻)に電子が満たされていくことから「内部遷移元素」とも呼ばれます。一つの軌道には2個の電子が収容されますが,軌道に1個だけ収容されている電子は「不対電子」です(次の表では黄色で示しました)。第一遷移元素(21Sc~29Cu)では3d軌道に,ランタノイド元素では4f軌道に不対電子があります。
ランタノイド系列の原子の電子配置は,K殻,L殻,M殻,及びN殻(4s,4p,4d軌道),O殻(5s,5d軌道)は不活性ガスのキセノン(54Xe)と同じで,更に外側の6s軌道(P殻)に電子が入った後に4fと5dの各軌道に電子が入っていきます。
ランタノイドの+Ⅲ価イオンでは,5d及び6s軌道の電子は無くなり,更に不足する場合は4f軌道の電子を加えて3個の電子を放出しています。また,4f軌道の電子は電子数が多いほど原子核に強く引き付けられるので,イオンは原子番号の増加に伴って小さくなる傾向が見られ,このことは「ランタノイド収縮」と呼ばれます。
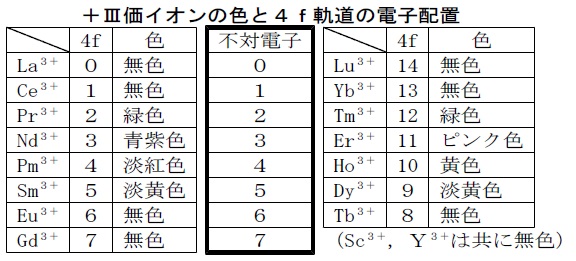
不対電子は光や電気などのエネルギーを受け取ると他の軌道に一時的に移り,元の軌道に戻るときに,受け取ったエネルギーを光として放出します。元素のうちで,発光する元素はランタノイド系列と第一遷移元素に集中していますが,これらの元素に共通しているのは内殻軌道に不対電子があることです。不対電子の作用によって発光が起きたり磁気モーメントが生じたりするのです。また,電子が2個の場合,スピンの向きが逆なので打ち消し合って磁気モーメントを生じませんが,1個の場合は電子のもつ角運動量に応じて磁気モーメントを生じます。第一遷移元素の鉄・コバルト・ニッケル,ランタノイド元素のネオジム・サマリウムなどは良い磁石用材料です。
上表から,不対電子の数をもとにして+Ⅲ価イオンを並べ替えたものが次の表です。左右のイオンの色は,おおよそ同系色です。4f軌道にn個の電子をもつ+Ⅲ価イオンと(14-n)個の電子をもつ+Ⅲ価イオンは,内部軌道の電子配置,とりわけ不対電子数が同じなので,吸収スペクトルが類似であると考えられます。
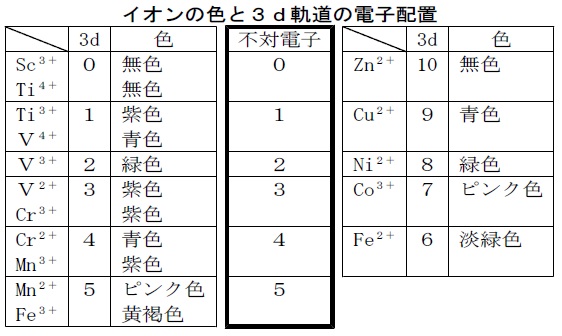
周期表第四周期(3dブロック)の遷移元素での3d軌道にある不対電子の数と色との関係(次表)でも,同様の傾向がみられます。多くの遷移金属イオンでは錯化剤によって外側の電子配置が影響を受けて吸収スペクトルが著しく変化しますが,ランタノイドでは,錯体を形成しても変化しにくい性質があります。
参考文献
希土類元素の探求(1),奥野久輝,現代化学・1972年1月号,東京化学同人
「ヘスロップ・ジョーンズ無機化学(下)」R.ヘスロップ・K.ジョーンズ著,齊藤喜彦著(東京化学同人,1978年)
「一般教育無機化学」鈴木康雄著(東京教学社,1979年)
「元素発見の歴史3」M.ウィークス・H.レスター著,大沼正則監訳(朝倉書店,1990年)
「希土類の話」鈴木康雄著(裳華房,1998年)
園部利彦
最新記事 by 園部利彦 (全て見る)
- ドブニウム(Db)とハッシウム(Hs)-消えた元素名と共に - 2024年3月18日
- ラザホージウム(Rf)-〝原子核物理学の父〟の名をもつ元素 - 2024年2月19日
- フランシウム(Fr)-周期表の左下端に位置する元素 - 2024年1月22日