| 亜鉛を含む鉱石としては閃亜鉛鉱などが知られています。製錬法には乾式法と湿式法(電解法)があり,歴史的には乾式法が先行しました。亜鉛の二回目は鉱石と製錬に焦点を当てます。 |
興味深い亜鉛鉱石の数々
亜鉛の原料鉱はほとんどが閃亜鉛鉱(ZnS)です。閃亜鉛鉱の英名はスファレライト(sphalerite)で,ジンクブレンド(zinc blende)という名前もおなじみです。
乾式法での亜鉛は鉛製錬における副産物で,表面に櫛の歯状の筋ができることが,亜鉛を意味するzinc(英,仏)やZink(独)の語源になっています。また,ドイツ語には,「(フォークや櫛の)歯,枘(臍)」を意味する名詞Zinke,「歯(または枘)を付ける」を意味する動詞zinken,「歯(または尖頂)のある」を意味する形容詞zinkigがあります。
次に,blendの原義は「混ぜる」ことですが,「分からなくする,欺く」という意味もあります。閃亜鉛鉱は方鉛鉱(PbS)に伴って産出することが多く,かつては方鉛鉱は有用な鉛の原料でしたが,閃亜鉛鉱は利用する技術が無く,そのため,役立たずで鉛鉱石の紛い物として扱われました。また,副成分の鉄の含有量の多寡に応じて,黒色不透明のものから黄褐色ないしは緑色で透明のものまであり,その鑑別が難しく,そうしたことから人を欺くという意味も込められたようです。

閃亜鉛鉱
(秋田大学鉱業博物館所蔵)
次の写真は菱亜鉛鉱(ZnCO3)です。カラフルですね。菱亜鉛鉱は方解石と同じ結晶構造(六方晶系)ですが,結晶格子に隙間があり,そこに銅イオンが入ると緑~青緑色,カドミウムイオンが入ると黄色,コバルトイオンが入るとピンク色を呈します。無色や白色のものの方が少ないほどです。また,方解石に特徴的な劈開や複屈折という性質も顕著ではありません。
菱亜鉛鉱の英名スミソナイト(smithsonite)は,イギリスの鉱物学者J.スミソンに因むもので,1832年にフランスの鉱物学者F.ブーダンによって命名されました。スミソンは,同じく亜鉛のケイ酸塩鉱物で成分が異なる異極鉱(Zn4Si2O7(OH)2・H2O)と菱亜鉛鉱を最初に区別した人で,アメリカのスミソニアン博物館を創設したことでも知られています。

亜鉛鉱
(名古屋市科学館「国際周期表年2019特別展」の展示,令和元年9月撮影)
亜鉛の鉱石をもう一つご紹介しましょう。それは珪酸亜鉛鉱(ZnSiO4,珪亜鉛鉱とも)で,アメリカ・ニュージャージー州で産するものがよく知られています。紫外線によって強い緑色蛍光を発する(稀に紫外線の照射をやめても光る燐光が見られる)性質が特徴的です。


同じものを右は紫外線照射下で撮影(緑色蛍光が斑点状に見られる)
亜鉛の製錬法-乾式法と湿式法
乾式法では,亜鉛精鉱(主に精製された閃亜鉛鉱)と鉛精鉱(精製された方鉛鉱)を熔鉱炉に入れ,コークスで還元して両者の合金を得ます。この合金を,亜鉛の沸点(907℃)以上で鉛の沸点(1749℃)以下の温度(1300℃程度)に加熱し,一酸化炭素を伴って蒸発してくる亜鉛を炉頂部から取り出して熔融亜鉛(約480℃)に捕捉するのです。この液体を鉛の融点(327℃)より高く亜鉛の融点(420℃)より低い温度に保つと,固体の亜鉛が析出します。
乾式法で得られる亜鉛は「蒸溜亜鉛」と呼ばれ,その純度は98.5~99.5%です。これに対して湿式法では99.997%以上の品位の亜鉛が得られ,湿式法は環境対策においても乾式法に較べて有利であることなどから,現在では亜鉛地金の約8割が湿式法で生産されています。
湿式法では,精鉱の焙焼で得た酸化亜鉛を稀硫酸に溶かして得られる硫酸亜鉛(ZnSO4)水溶液から,不純物の鉄イオンなどを除去した後に,銀を約1%含む鉛を陽極,アルミニウムを陰極とした電解槽で電気分解します。
では,亜鉛のイオン化傾向が水素より大きいにもかかわらず,陰極に亜鉛が得られるのはなぜでしょう。それは亜鉛表面の水素過電圧が大きいことで説明されます。
過電圧は,熱力学的に求められる反応の理論電位と,実際に反応が進行するときの電極電位との差で,その値は電極の材質,電解液の濃度,電流・電圧などの条件により変容します。水素イオンが電子を受け取って水素分子を生成するとき,活性化状態(H…H)を経ます。ここで,反応物(2H++e-)と生成物(H2)のエネルギー差が理論上の必要なエネルギー,すなわち反応熱ですが,反応物から活性化状態に至るのに必要なエネルギー(活性化エネルギー)が大きいと反応は進行しにくくなります。
式 2H+ + 2e- ① [ H…H ] ② H2
式 2H+ + 2e- → [ H…H ] → H2
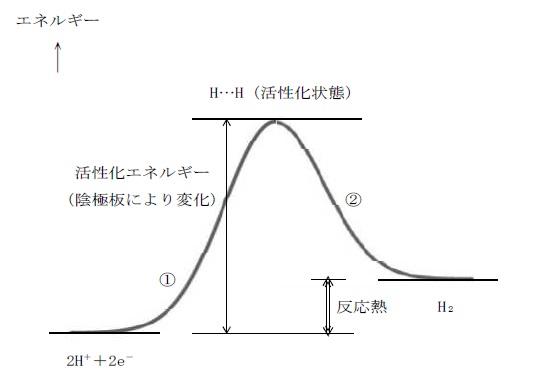
電気分解で陰極に水銀や亜鉛があると,水素生成反応の活性化エネルギー(上式①)を増大させます(これらの金属は「水素過電圧が大きい」と言われます)。過電圧の値は金属の種類によって異なり,その順序は以下のようです。
Pt<Pd<W<Fe<Cr<Ag<Cu<Pb<Zn<Hg
このように陰極の材質によって水素の生成は抑制され,亜鉛イオンが水素イオンよりも容易に電子を受け取って単体になるのです。
亜鉛は,真鍮や洋銀(銅,ニッケルとの合金,洋白とも)などの合金に使われるほかに,トタン(亜鉛めっき鋼板)として広い用途があります。単体は,電池の電極材料や各種の還元剤として使われます。代表的な化合物では,酸化亜鉛は「亜鉛華」とも呼ばれ,白色顔料として工業用材料,化粧品・日焼け止め・医薬品などに使われています。
参考文献■
「電気化学Ⅰ」吉沢四郎,渡辺信淳共著(共立出版,1977年)
「楽しい鉱物図鑑」堀 秀道著(草思社,2013年)
「金属製錬学」秋田大学理工学部(2015年)
園部利彦
最新記事 by 園部利彦 (全て見る)
- 銀(Ag)-銀塩写真の周辺 - 2025年6月16日
- 窒素(N)-有機化学への扉を開いた異性体 - 2025年5月19日
- ラドン(Rn)-多くの名前で呼ばれた放射性の稀ガス元素 - 2025年4月21日