2023年の日本における粗鋼生産量は8700万トン[1]で、中国、インドに次いで世界第3位の規模です。日本の製鉄業は優秀な品質を誇り、現在も我が国における極めて重要な産業の一つです。しかし、製鉄業は二酸化炭素の排出が多いことでもよく知られています。日本の産業部門では二酸化炭素排出の40%を製鉄業が占めているとも言われています[2]。鉄を鉄鉱石(主に鉄の酸化物)から作るためには、酸化物を還元しなければなりません。そのためにはコークスが使われてきました。コークスは石炭を蒸し焼き(空気を絶った条件で加熱すること)にして作られるもので、炭素の割合が80-90%程度まで高められています。このコークスと鉄鉱石(赤鉄鉱(Fe2O3)、磁鉄鉱(Fe3O4)、褐鉄鉱(Fe2O3•nH2O)など)を反応させると、鉄鉱石中の酸素がコークス中の炭素と結合して、鉄が得られ、炭素は最終的には二酸化炭素になります。従って、製鉄所は大量の二酸化炭素を排出することになるのです。
日本を含む多くの国が2050年にカーボンニュートラルを実現するという目標を掲げ[3]、二酸化炭素の排出削減に取り組んでいますが、製鉄業界でも従来の方法から脱却することが強く求められています。日本の製鉄業においても官民協力により様々な方策が研究されています[2]。コークスではなくて水素で鉄鉱石を還元すれば原理的には副生成物は水のみなので、理想的な方法です。コークスを使うと、発熱反応なので高炉内は勝手に高温になって都合が良いのですが、水素を使う還元反応は吸熱反応で、鉄を溶かすには別途燃料が必要となります。そこで現在は、コークスを一部水素に置き換える方法が試されており、最近では30%以上の二酸化炭素削減に成功したというニュースも伝えられています[4]。
さて、ごく最近米国の研究者が電気を使って鉄鉱石を還元するプロセスを考案しました[5]。これはアルカリ性水溶液中で酸化鉄Fe2O3を電気によって還元する方法と、食塩水を電気分解して塩素を製造する方法を組み合わせるというアイデアです。いずれのやり方も従来から知られていたもので、特に後者は塩素と水酸化ナトリウムの製造法として世界中で大規模に行われている方法です。
まず、現在工業的に行われている食塩水の電気分解について説明しましょう。この方法は陽イオンのみを通過させることができる特別な材料でできている膜を使って、水槽を左右に分けることがミソです。図1のような装置を考え、右側には食塩水が、左側には真水が入っているとします。電気分解を行うと、右側で塩素(Cl2)が発生し、ナトリウムイオンは左側に移動します。左側では水素が発生し、水がしだいに水酸化ナトリウム溶液となっていきます。反応の進行に伴い、右側の槽には食塩水を加え、左側の槽には水を加えていくと、塩素と水素と水酸化ナトリウムが生成することになります。日本でもこの方法で水道の殺菌や各種材料の原料などとして用いる塩素や、水酸化ナトリウムが毎年数百万トン規模で製造されています。
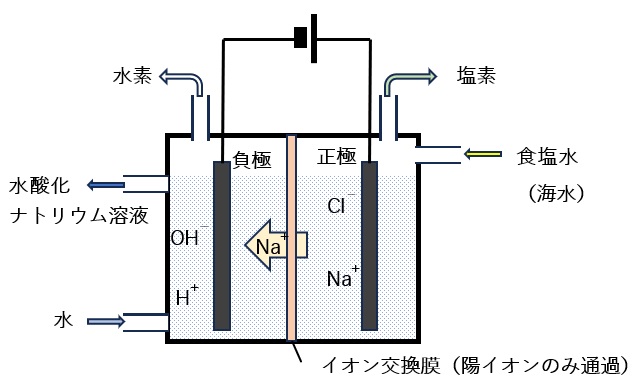 図1 イオン交換膜を使う食塩水の電気分解装置。水槽の右側には食塩水を入れ、塩素が発生する。余ったナトリウムイオンは膜を通過して水槽の左側に移動する。左側では水が供給されて水素が発生し、余ったOH−イオンと合わさって水酸化ナトリウム水溶液となる。
図1 イオン交換膜を使う食塩水の電気分解装置。水槽の右側には食塩水を入れ、塩素が発生する。余ったナトリウムイオンは膜を通過して水槽の左側に移動する。左側では水が供給されて水素が発生し、余ったOH−イオンと合わさって水酸化ナトリウム水溶液となる。
一方水酸化ナトリウム水溶液などのアルカリ性水溶液中で酸化鉄の電気還元が行えることも知られていました。米国のKemplerらは、これらの食塩水の電気分解と酸化鉄の電気的な還元を組み合わせることを思いつきました。図2に示すように図1の左側を酸化鉄の還元槽としたのです。その結果図3に示すように、反応が進むにつれて、負極の回りの酸化鉄が鉄に変化していくことが分かりました。
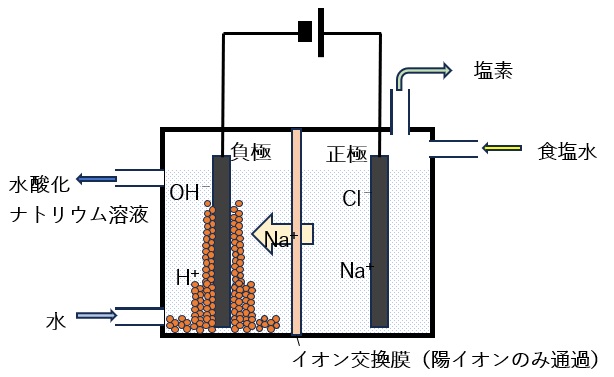 図2 図1の装置で左側の水槽には酸化鉄(茶色の粒)を入れた場合。この場合、右側の水槽では図1と同様塩素Cl2が発生するが、左側の水槽では、水は水酸化ナトリウム水溶液に変化するが、水素H2が発生する代わりに酸化鉄が還元されて鉄となる。
図2 図1の装置で左側の水槽には酸化鉄(茶色の粒)を入れた場合。この場合、右側の水槽では図1と同様塩素Cl2が発生するが、左側の水槽では、水は水酸化ナトリウム水溶液に変化するが、水素H2が発生する代わりに酸化鉄が還元されて鉄となる。
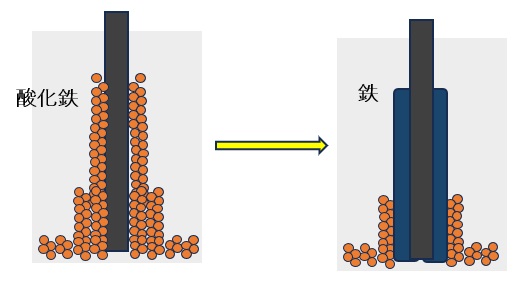 図3 図2の装置で電気分解を行ったときの負極の回りの変化。
図3 図2の装置で電気分解を行ったときの負極の回りの変化。
電気分解前(左)では、電極の回りには酸化鉄(茶色の粒)が付着している。電気分解後(右)は電極に近いところにあった酸化鉄は還元され、鉄の粉末となっている。
つまり、以下の反応式のように、図2の水槽の左側では酸化鉄が還元されると同時に水酸化ナトリウムが生成します。
Fe2O3 + 6 Na+ + 3 H2O + 6 e− → 2 Fe + 6 NaOH (水槽左側)
なお、右側では図1と同様塩素が発生します。
2 Cl− → Cl2 + 2 e− (水槽右側)
両者の式を組み合わせると以下の式となり、これが図2の装置で生じる全体の反応式となります。
Fe2O3 + 6 NaCl + 3 H2O → 2 Fe + 6 NaOH + 3 Cl2 (水槽全体)
この反応では電流値をちょうど良い具合にセットすることで、非常に効率よく酸化鉄の還元が進み、また得られた鉄は簡単に電極から落とすことができて95%の純度であったと報告しています。この反応の最大の長所であり、かつネックでもあることは、塩素が鉄の3倍(物質量で)生成することです。塩素の現在の消費量から考えると、世界のすべての塩素生産(およそ毎年1億t)をこの方法にしたとしても鉄の製造量の3%程度しか置き換えられないとのことです。それでも1億t以上の二酸化炭素の排出削減になるということですからたいへんなものです。
以上のようにこの方法は鉄鋼生産の問題点をすべて解決できるというものではありませんが、非常に面白いアイデアだと思いました。まだまだこの問題に対しても様々な可能性があるということが示されたという意味でも非常に価値のある研究だと感じました。ではまた次回。
[1] 日本鉄鋼連盟のサイトによる。https://www.jisf.or.jp/data/seisan/month.html 以下も含めてwebサイトはすべて2024年5月1日閲覧。
[2] NEDO(新エネルギー・産業技術総合開発機構)のサイトhttps://green-innovation.nedo.go.jp/article/iron-steelmaking/
[3] 環境省「 2050年カーボンニュートラルの実現に向けて」https://www.env.go.jp/earth/2050carbon_neutral.html
[4] 日本製鉄株式会社ニュースリリースhttps://www.nipponsteel.com/news/20240206_100.html
[5] B. B. Noble, A. Konovalova, L. J. Moutarlier, V. Brogden and P. A. Kempler, Joule, 2024, 8, 714–727.
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 新たな生体埋め込み型電池の開発 - 2024年7月22日
- 二酸化炭素排出ゼロを目指す製鉄方法 - 2024年6月10日
- 都市鉱山からの低コスト高効率金回収 - 2024年5月13日