元素記号Cs、原子番号55番の元素、セシウム。
元素名はラテン語で青空色(caesius)による。2人のドイツ人化学者ブンゼンとキルヒホフが、1860年に当時の新技術である分光法における発光スペクトルの中に、青色の新しい輝線を発見したことがセシウムの発見となった。ちなみにセシウムは分光法で発見された初めての元素である。セシウムは水銀についで2番目に融点の低い金属元素だ。アルカリ金属のうちで最も反応性に富み、自然界には広く分布するがその量は非常に少ない。日本の天然の温泉水に0.01~6.2 mg/Lの濃度範囲で含まれていることも知られている。
セシウムを含む天然鉱石にはペツォッタ石、ポルックス石がある。ポルックス石の名前は、良く似た鉱物結晶(カストル石)と同時に発見されたため、双子座の星になったというギリシャ神話の双子の兄弟カストルとポルックスに因んでいる。
 左から:金属セシウム、ペツォッタ石Cs(Be2,Li)Al2Si6O18、ポルックス石(Cs,Na)2Al2Si4O12·2H2O、カストル石(ペタル石)LiAlSi4O10
左から:金属セシウム、ペツォッタ石Cs(Be2,Li)Al2Si6O18、ポルックス石(Cs,Na)2Al2Si4O12·2H2O、カストル石(ペタル石)LiAlSi4O10
・金属セシウム:Dnn87による”Cesium/Caesium metal from the Dennis s.k collection” CC BY-SA 3.0
・ペツォッタ石、ポルックス石、カストル石(写真提供協力:「鉱物たちの庭」ホームページ)
 Giovanni Battista Cipriani (1727–1785) が描いたギリシャ神話の双子の兄弟カストルとポルックス, 1783
Giovanni Battista Cipriani (1727–1785) が描いたギリシャ神話の双子の兄弟カストルとポルックス, 1783
ポルックス石(ポルサイト鉱石)を原料としてセシウム化合物が生産されている。化学工業的な利用としては硝酸セシウムの形態が最も多く、メタアクリル樹脂用やポリウレタンなど有機化学合成の触媒となる。またセシウムは原子時計の基準点(参考:原子時計に関する過去のブログはこちら)、光電セル、磁器センサー、ガンマ線検出用シンチレーション検出器におけるシンチレーターなどにも使われる。また放射性同位体のセシウム137は強いガンマ線を放つので、ガンマ線照射線源として、農業用やがん治療、医療機器の殺菌に用いられている。
原子力発電所の事故で、放射性「セシウム」が飛散したと耳にしたことがあるだろう。ではそのセシウムはどこから来るのか?原子燃料に含まれているのではない。図が示すように原子燃料中のウラン235の中性子の衝突による核分裂によってできる「片割れ」の代表的なパターンのひとつがセシウム137である。核分裂によってできる元素はセシウムだけでなく、ヨウ素131やルビジウム95などのこともある。これらの片割れが、さらに放射性崩壊を繰り返し別の元素、例えばストロンチウム95などに姿を変えていく。
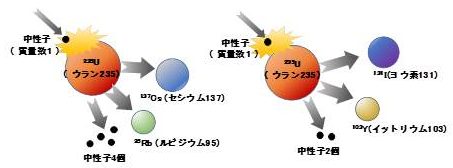 ウラン235の核分裂のパターンの例(イメージ図
ウラン235の核分裂のパターンの例(イメージ図
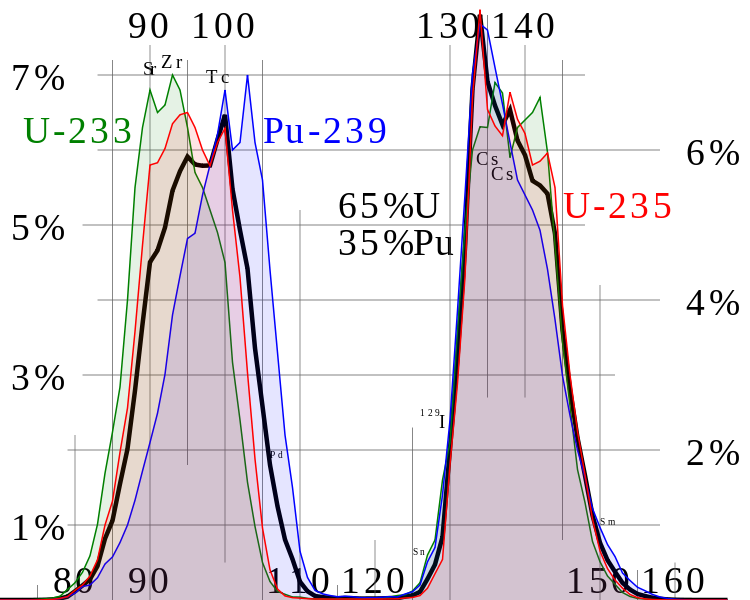 ウラン235の核分裂によってできる2つの「核分裂生成物」の質量数範囲(赤線)
ウラン235の核分裂によってできる2つの「核分裂生成物」の質量数範囲(赤線)
(U233とPu239の分裂についても併記されている)
JWBによる”Thermal fission yield” CC BY 3.0
実験1 セシウムと水の反応
アルカリ金属、つまりナトリウムやカリウムが水と反応すると劇的に熱と光を発することは有名だ。セシウムも同様だが、ナトリウムよりもカリウムよりも、さらに激しい反応を見せる。
これらは水となぜこのような激しい反応をするのだろう?「それは、アルカリ金属と水との反応で発生した水素ガスが、同じく反応で生じた熱によって発火することによる」と、単純に説明されてきたが・・・。どうやらその裏側にはもっと興味深い反応が隠れている。その事実が、チェコ共和国科学アカデミーのPavel Jungwirth研究員らにより、ここ最近になって発見された。
アルカリ金属と水との反応はそう単純ではなく、金属からの大量の電子放出が起き、それらの電子はすぐに水和して水和電子となり青紫色の光を発する。そして金属のバルク内部には陽イオンがたくさん残されることとなり、陽イオンどうしが電気的反発する「クーロン爆発」が生じている。これらの様子が、みごとにハイスピードカメラで捉えられた画像が論文に紹介されている。
また、次の動画ではセシウムの封入されているガラスアンプルを割って、水と反応させた様子が紹介されている。
動画提供:Dr. Kurt Winklemann, Florida Institute of Technology
実験2 土壌中のセシウムの抽出と回収
産総研(国立研究開発法人産業技術総合研究所)の研究グループが、2011年に土壌中のセシウムを低濃度の酸水溶液を用いて抽出し、さらにそのセシウムを吸着材で回収する技術を開発し、発表した。
土壌の重量に対して用いる酸水溶液の重量比(固液比)を上げ、200 ℃などの高温で処理すると、セシウムイオンを低濃度の酸水溶液中に抽出できることがポイントである。グラフに、抽出温度と抽出率の関係が示されており、高温ほどよく抽出できることがわかる。抽出したセシウムイオンを、土壌の1/150の重量のプルシアンブルーナノ粒子吸着材で回収すると放射性セシウムの除去に効果的であるという。
プルシアンブルーは、一般的な組成式AyFe[Fe(CN)6]x・zH20(Aはセシウムイオンなどの陽イオン)で示される人工的に合成される顔料。製法によりベルリンブルー、タンブルブルーとも呼ばれる。左下の図のように格子状の形状を持つため、内部に空隙にセシウムを取り込むと考えられている。海水のようにナトリウムイオンやカリウムイオンなど、類似のイオンが存在している環境でも、セシウムイオンを選択的に吸着する能力を持っている。土壌から水溶液に抽出される濃度が10 ppbとかなり低濃度であっても最大で99.9%の回収が可能である。
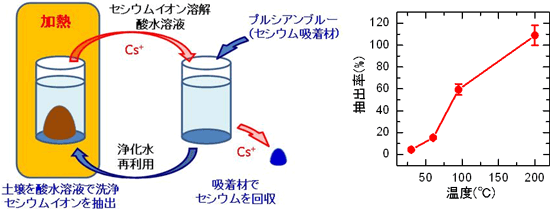
実験の概要(左上)とセシウムイオンの抽出率の温度依存性(右上)
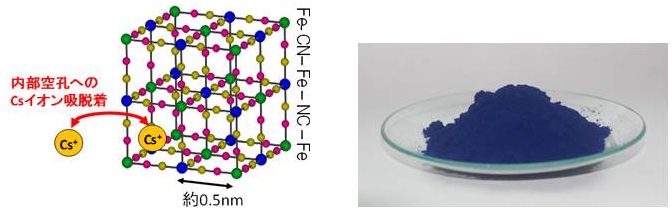
プルシアンブルーにセシウムイオンが吸着されるイメージ図(左下)とプルシアンブルー(右下)
左上、右上、左下:「国立研究開発法人産業技術総合研究所 提供」
右下: Saalebaerによる”The Pigment Prussian Blue was invented in 1706 and named after the country in which the invention took place” CC0
参考文献:
桜井弘「元素111の新知識(ブルーバックス)」、講談社、1997年
Chemical & Engineering News, CESIUM:http://pubs.acs.org/cen/80th/print/cesium.html
JOGMEC金属資源情報、36 セシウム(Cs):http://mric.jogmec.go.jp/public/report/2012-05/36.Cs_20120619.pdf
鉱物たちの庭ホームページ(ラズベリル、ポルックス石、ペタル石):http://www.ne.jp/asahi/lapis/fluorite/gallery/g2fr.html
http://www.ne.jp/asahi/lapis/fluorite/gallery8/540polluc.html
http://www.ne.jp/asahi/lapis/fluorite/gallery/g2fr.html
空想の宝石結晶博物館、ポルックス石とペタル石(カストール石):http://1st.geocities.jp/gemhall2/gemusplx.htm
太秦 康光・那須 淑子、「温泉水中のルビジウム,セシウム」日本化學雜誌、1963 年 84 巻 9 号 p. 726-731, A49
日本科学未来館、科学コミュニケーターとみる東日本大震災、原発の基礎知識、質問: 核分裂でできた物質の片割れはどこに?2011/04/20:https://www.miraikan.jst.go.jp/sp/case311/home/docs/energy/1104201603/index.html
産総研、土壌中のセシウムを低濃度の酸で抽出することに成功:https://www.aist.go.jp/aist_j/press_release/pr2011/pr20110831/pr20110831.html
Nature ダイジェスト Vol. 12 No. 4 News, 2015 「アルカリ金属の爆発の秘密が明らかに」:https://www.natureasia.com/ja-jp/ndigest/v12/n4/%E3%82%A2%E3%83%AB%E3%82%AB%E3%83%AA%E9%87%91%E5%B1%9E%E3%81%AE%E7%88%86%E7%99%BA%E3%81%AE%E7%A7%98%E5%AF%86%E3%81%8C%E6%98%8E%E3%82%89%E3%81%8B%E3%81%AB/61962
山﨑 友紀
最新記事 by 山﨑 友紀 (全て見る)
- 実験講座 番外編 アメリカ、サンフランシスコ湾での天然塩づくり - 2024年3月25日
- 実験講座 番外編 アメリカ カリフォルニアで見た多様な鳥たち - 2024年1月29日
- 実験講座 番外編 アメリカCalifornia Academy of Science(科学博物館)訪問 - 2023年11月27日