
元素記号Fe、原子番号26番の元素「鉄」。純度の高い鉄はキラキラと銀白色に光る。しかしそれがイオン、沈殿、化合物などとなると、組成、結晶構造、条件などに応じて様々な色を示すことをご存知だろうか?ある種の化学反応では鉄の作用によって発光することもある。今回は私たちの生活に身近な「鉄」について、色の話を中心に紹介しよう。
身近でもっとも重要な金属
鉄は古くから地球の形成と生命の誕生に寄与し、人類の文明や技術の歴史と深くかかわってきた。鉄をたくさん含む隕石が繰り返し衝突して形成された惑星地球には大量の鉄がある。地球の内核は純度の高い液体の鉄と考えられており、地殻の岩石や地表の土にもたくさん含まれている。
生物にとっては細胞の代謝や血液の成分として必須の元素である。赤土の色も、血液の赤い色も鉄からきているのだ。また、人類の文明の発展において鉄は欠かせなかった。人は岩石に含まれている鉄を取り出し、純度を上げ、強度を上げて材料としての価値を高めてきた。車輪の利用、蒸気機関の発明、航空機の実現などのあらゆるイノベーションの側面で鉄は主役を担ってきたのだ。しかも、鉄は資源量が豊富なベースメタルの仲間だ。様々な工具、橋やビルなどの構造物、鉄道などの輸送機関などにもたくさん用いられている。
近年の話題として、鉄から限りなく不純物を取り除いた「高純度鉄」(市場に出回っている純鉄のさらに100分の1程度の不純物量の鉄:純度99.9996%)が日本発、世界標準物質として認められている。「高純度鉄」は従来の鉄とは全く異なり、錆びない、塩酸に溶けない、硬さや熱伝導率が非常に高いなど、非常にユニークな特性を持つのだ。
化粧品
鉄を含む無機顔料は、化学的・物理的に安定で安全性も高く、複数のカラーバリエーションを示すことから、ファンデーション、アイシャドウ、アイライナー、マスカラ、アイブロウ、口紅といった化粧品にも使われている。
ファンデーションにおいては、ナチュラルな肌色を実現するために赤、黄、黒などの鉄系顔料を適度に組み合わせ、酸化チタンなどの白い母材に混ぜられて使われる。赤色の鉄系顔料は「べんがら」とも呼ばれ、酸化第二鉄(Fe2O3)を主成分とする。この名前の由来はインドのベンガル地方から伝わったことのようだ。黄色の鉄系顔料の主成分はゲーサイト(水和酸化鉄,α-FeOOH)で、黒色の鉄系顔料の主成分は磁鉄鉱(またはマグネタイト、Fe3O4)である。褐色のマグヘマイト(γ-Fe2O3)や赤褐色のレピドクロサイト(γ-FeOOH)など違う色の鉄系顔料もある。ぜひ一度、化粧品の成分表をチェックしてみよう。
釉薬
鉄は酸化・還元状態、共存する物質などによっても様々な色を示すことができる。セラミック(陶器、磁器、タイルなど)の釉薬としても世界中あちこちで長年使われてきた。下地の土の色、焼成条件(温度や酸素量)、鉄の量や添加物などを組み合わせれば、黄、橙、緑、青、赤、紫、茶、黒などの様々な色を作ることができる。同じ元素でこれだけ様々な色を見せられるものは他にはない。
 鉄系釉薬の例 左から飴釉 銀油滴天目釉 黒天目釉 海鼡釉 黄瀬戸釉 柿天目釉
鉄系釉薬の例 左から飴釉 銀油滴天目釉 黒天目釉 海鼡釉 黄瀬戸釉 柿天目釉
株式会社竹昇精工 陶芸部 提供 (https://www.tougeishop.com/abouts/)
水溶液中の鉄の色
鉄は水溶液中、イオンの価数やpH、錯体形成の相手となる物質によってバリエーション豊かな色を見せることができる。実験室では例えば塩化鉄(Ⅱ):FeCl2または塩化鉄(Ⅲ):FeCl3の水溶液を準備し、下の写真に紹介されている様々な試薬を加えていくことでカラフルな変化を見ることができる。

数研出版株式会社 提供(三訂版 視覚でとらえるフォトサイエンス化学図録)転載禁止
鉄の色の変化は有機物との反応でも起こる。例えば日本薬局方で採用されているフラボノイドなどの生薬中フェノールの確認試験法では、独特の青~紫の変化がポイントとなる。高校化学の教科書にも、フェノール類の特徴および検出方法、または鉄の呈色反応として紹介されている。原理は鉄イオンがフェノールとの結合状態によって特定の色を示すことにある。
 なんとなく実験しています 提供(https://blogs.yahoo.co.jp/canacana44/36421652.htm)
なんとなく実験しています 提供(https://blogs.yahoo.co.jp/canacana44/36421652.htm)
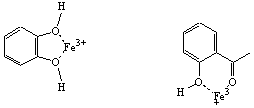 植物由来の成分にはカテコール(左)やサリチル酸(右)などのフェノール構造が含まれている。
植物由来の成分にはカテコール(左)やサリチル酸(右)などのフェノール構造が含まれている。
ルミノール反応
テレビドラマなどでも紹介されているこの反応は、ルミノール(C8H7N3O2)が塩基の作用で3-アミノフタル酸に酸化される際に、3-アミノフタル酸が励起状態から基底状態に遷移するときに青色の蛍光を発する化学発光である。このとき鉄が触媒の役割を担う。実験を行う際には、A液としてルミノールを水酸化ナトリウム水溶液に溶かして過酸化水素水と混合したもの、およびB液としてフェリシアン化カリウムの水溶液を準備し、A液にB液を加えるだけで発光を見ることができる。ただ、発光時間は短く、あっという間に終わってしまうため、A液とB液を混合する前に、部屋を暗くしておく必要がある。
ルミノール反応は実際の科学捜査における血痕の鑑識に用いられている。血液中のヘモグロビンに含まれている鉄が反応の触媒となって発光する。実験教室などで、科学捜査っぽく演出したい場合には、写真の右のように紙にB液をしみこませておき、A液をスプレーすると字や記号などを青い光とともに浮かび上がらすことができ、観客をアッと言わすことができる。

ルミノール反応の様子
鉄の他の反応
鉄は身近な材料であることから、学校の化学実験でもよく利用される。使い捨てカイロの試作、スチールウールの燃焼実験、硫化水素発生実験、テルミット反応などなど。テルミット反応そのものは発色したり発光したりしないが、酸化鉄が還元される反応において、激しい炎と火花を見ることができる。いずれの実験においても十分な注意が必要であるが、鉄の七変化を実感してみてはいかがだろうか。
参考資料
超高純度金属の実用化への道https://www.jstage.jst.go.jp/article/materia/52/6/52_259/_pdf
J.Jpn. Soc. Colour Mater., 84[10], 351–357(2011)
医薬品医療機器総合機構https://www.pmda.go.jp/files/000210790.pdf
山﨑 友紀
最新記事 by 山﨑 友紀 (全て見る)
- 実験講座 番外編 アメリカ、サンフランシスコ湾での天然塩づくり - 2024年3月25日
- 実験講座 番外編 アメリカ カリフォルニアで見た多様な鳥たち - 2024年1月29日
- 実験講座 番外編 アメリカCalifornia Academy of Science(科学博物館)訪問 - 2023年11月27日