
| 水銀に関わる歴史の2話目では、水銀化合物を用いる二つの試薬、ミロン試薬とネスラー試薬を取り上げます。現在では機器分析など別の方法で行われますが、ミロンとネスラーは、それぞれの研究から検査法を創案し、医学・薬学の分野で貢献しました。 |
水銀化合物の毒性と利用
水銀化合物は、ヒ素化合物と並び、古くから毒性が知られていました。例えば辰砂(主成分はHgS)は不死の薬として珍重されましたが、服用した多くの権力者が中毒で落命したようです。インドでは、既に12世紀に甘汞と昇汞がつくられていました。甘汞は塩化水銀(Ⅰ)(Hg2Cl2)で、かつては白粉・下剤・利尿剤として利用され、昇汞は塩化水銀(Ⅱ)(HgCl2)で、蛋白質を変性させることで強い毒性を示します。
中世以降、水銀化合物は毒として認知されるようになり、時には権力争いの解決手段にさえなりました。禁断の作用に魅了されたのは、良識が求められるべき学者や医師・調剤師とて同じで、中には危うい議論に花を咲かせ、様々な物質を試さずにはいられなかった者もいましたが、その一方では医学や化学が進展しました。水銀化合物は、諸刃の剣のような性質ながら、近年になって世界的に規制されるまで医薬品や農薬などとして広く使われました。
ミロン試薬 ーフェノール類及び蛋白質の検出
E.ミロンは1812年に生まれてパリのコレージュに学び、1832年から軍の病院で外科の教育と訓練を受け、卒業後はリヨンなどに従軍しました。1841年には化学の教授になりましたが、1847年からはリールの陸軍病院に勤めました。
フランスでは、1830年の七月革命で保守派のブルボン朝が倒され、いわゆる七月王政が始まりました。七月革命は欧州各地に影響を与え、フランス国内では反動化した王に対して労働者や農民による王政打倒の機運が高まり、1848年の二月革命で第二共和制が成立しました。
ミロンは、この間の多くを軍務に従事し、研究に正面から向き合うことはできなかったようですが、そうした中で1846年にアミノ酸の検出方法を開発しました。アミノ酸の定性分析は、医学分野では代謝異常などの病気のスクリーニング検査としての必要性があり、ミロン試薬はチロシン(H2NーCH(CH2C6H4OH)-COOH)を検出する試薬です。
ミロン試薬は、水銀を濃硝酸または発煙硝酸に溶かし、その上澄液を水で稀釈して調製されます。このとき、水銀は濃硝酸に酸化されて水銀(Ⅱ)イオンになります。
Hg+4HNO3→Hg(NO3)2+2NO2+2H2O
蛋白質の溶液あるいはフェノール性のヒドロキシ基を有する化合物の溶液にミロン試薬を加えると白色沈澱を生じ、これを加熱すると沈澱は赤褐色に変わるか、溶けて赤色の溶液になります。しかし、直接水銀から調製された試薬は感度が低下しがちなことから、試料溶液に硫酸水銀(Ⅱ)の硫酸酸性溶液を加え、加熱後に亜硝酸ナトリウム水溶液を加えるという改良法が考案されました。
ミロン反応(フェノール性ヒドロキシ基の呈色)の応用
ミロン試薬は、フェノール類(フェノール,クレゾール,サリチル酸など)のほかに、フェニル基をもつチロシンを構成アミノ酸として含む蛋白質とも反応します。
チロシン(tyrosine)は1846年にドイツの有機化学者J.リービッヒによってチーズから発見され、その名前はギリシア語でチーズを意味するτυρος から付けられました。身近なところでは、納豆の発酵が進むと大豆蛋白質の分解で生じたチロシンが増え、水に溶けにくいチロシンは豆の表面に白く析出して、ざらついた食感になります。長期間熟成させて作られるパルメザンチーズでも同様のことが起きますし、水煮タケノコの節などに見られる白い物質もチロシンです。
チロシンはまた、リンゴ,モモ,バナナを褐色にする原因物質としても知られています。これらの果実に含まれるポリフェノールが空気に触れると、酵素により分解されてチロシンが生じるのです。

パルメザンチーズ(熟成期間が長く,チロシンの結晶が観察されやすい)
ほとんどの蛋白質はチロシンを含みますので、ミロン試薬は蛋白質の検出用試薬にもなります。カゼインや絹糸などは酸による加水分解、あるいは腐敗や酵素による分解によってチロシンを生じますので、繊維に蛋白質成分が含まれるかどうかをミロン反応の有無で鑑別することができます。更に、プラスチックの乾溜生成物にミロン試薬を加えて濃赤色から褐色を呈すれば、フェノールやクレゾールの存在が分かります。
ネスラー試薬 ーアンモニア及びアンモニウム塩の検出・定量
J.ネスラーは1827年に生まれ、薬剤師助手として約10年間働いた後、1853年から1856年までフライブルク大学で薬学を学びました。
ドイツでは、ナポレオン後のウィーン体制下で保守的な体制が続きましたが、ブルジョワ階層が台頭し、1848年、欧州各地に起きた〝諸国民の春〟とも呼ばれる革命がドイツにも及びました。
若きネスラーもまた、その渦中にいました。大学でネスラーは、アンモニアに対するヨウ化水銀(Ⅱ)(HgI2)の作用を研究し、その成果として1856年にアンモニアを検出する新しい方法を発表したのです。博士号の取得後は、カールスルーエ近郊の化学工場に勤務し、ワインやタバコについて研究して地元の農業に貢献しました。
ネスラー試薬は、ヨウ化水銀(Ⅱ)とヨウ化カリウム(KI)を水に溶かしてから、水酸化カリウム(KOH)(または水酸化ナトリウム,NaOH)の水溶液を加えて調製されます。淡黄色で強アルカリ性の試薬で、アンモニアまたはアンモニウムイオンを含む水溶液と反応して、痕跡量の場合は溶液が黄色を呈し、多量の場合は赤褐色沈澱を生じます。感度はごく鋭敏なので、アンモニアやアンモニウム塩の定量も行うことができます。ネスラー試薬はまた、第一級アミン・第二級アミン・第三級アミンとも類似の反応をしますし、アンモニアを用いる水銀(Ⅱ)イオンの検出法としても使うことができます。
アンモニアと反応するのはテトラヨード水銀(Ⅱ)酸イオン([HgI4]2-)で、その反応は次のイオン反応式で表されます。
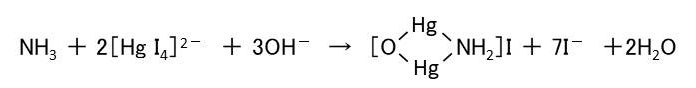
ところで、アンモニア水に酸化水銀(Ⅱ)(HgO)を加えると水酸化物(A)が生成します。(A)は鮮やかな黄色の物質ですが、1分子の水を失って(B)になると、暗褐色を呈します。この物質は「ミロン塩基」と呼ばれます。
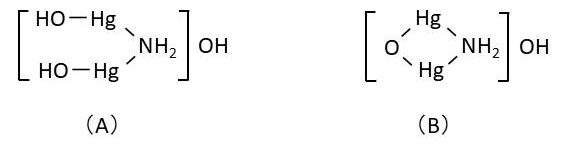
(B)の水酸化物イオンが他の1価陰イオン(X)に置き換わると、[OHg2NH2]X なる化合物になります(X=F-,Cl-,Br-,I-,CN-,NO3-,NO2-など)。つまり、ネスラー試薬での生成物([OHg2NH2]I)はミロン塩基のヨウ化物にあたるのです。
アンモニアが微量の場合の定量には比色法が有効で、ネスラーは専用の比色管を創案しました。蓋付き(共通摺り合わせ栓)の透明ガラス容器で、溶液の体積を示す標線が刻まれており、試料溶液と標準列呈色液をそれぞれ入れて色を観察します。ネスラー管は、その後、汎用比色管として使われるようになりました。

ネスラー比色管(ネスラー管)〔写真提供〕東京医科歯科大学法医学分野
参考文献:
「新訂定性分析化学 中巻・イオン反応編」高木誠司著(南江堂・1984年)
「増訂化学実験事典」赤堀四郎・木村健二郎監修(講談社,1984年)
「化学語源ものがたり」竹本喜一,金岡喜久子著(化学同人,1986年)
「化学大辞典」化学大辞典編集委員会(共立出版,1989年)
「シリーズ《食品の科学》 果実の科学」伊藤三郎編(朝倉書店,1993年)
「シリーズ《食品の科学》 乳の科学」上野川修一編(朝倉書店,1996年)
「毒の歴史 人類の営みの裏の軌跡」J.マレッシ著,橋本 到・片桐 祐訳(新評論,1996年)
「科学用語 独-日-英語源辞典・ギリシア語篇」大槻真一郎著(同学社,1997年)
「南山堂医学大辞典」(南山堂,1999年)
園部利彦
最新記事 by 園部利彦 (全て見る)
- 銅(Cu)-あかがね,赤銅,緑青の元素 - 2024年7月8日
- 銀(Ag)-神経細胞の染色に有用な元素 - 2024年6月17日
- 金(Au)-薬になった金(金製剤)のお話 - 2024年5月27日