人類はアンモニアを多量に利用しています。アンモニアの世界での製造量は20世紀後半から飛躍的に増大し、年間1億8000万トンにも達しています[1]。主な用途は肥料です。肥料が不足すると食糧生産が滞り、爆発的に増加する人口を養えなくなる心配があります。アンモニアの製造には、高校でも習うハーバー・ボッシュ法が100年以上にわたって使われてきました。この方法では化学反応が数百気圧、数百度という条件で行われるため、エネルギー消費の点で、また安全性の点で改良すべき点が多々あります。
さて、植物に寄生している細菌は空気中の窒素からアンモニアを作ることができます。これをまねて、温和な条件でアンモニアを作ることが化学者の夢の一つであり、何十年もの間、化学研究者は新しい合成法を追い求め続けてきました。近年この分野の研究は急速に進んでおり、2019年には日本の化学者によって画期的な方法が見いだされ、そのことはこのブログでも以前紹介いたしました。最近では電気をつかってアンモニアを合成する方法の研究も進んでいます。今回はその方法の最前線の研究結果をご紹介しましょう。
窒素(N2)は、二つの窒素原子が非常に強固に結合しているため、きわめて反応しにくい分子です。しかし、リチウムは多数ある元素の中で、唯一その単体が気体の窒素と反応します。リチウム金属は加熱すると窒素と反応し、暗赤色の固体である窒化リチウム(LiN3)が生成するのです。窒化リチウムは水と反応するとアンモニアを生成します。このような性質から、アンモニアを合成する際にリチウムを用いると良いのではないかというアイデアは以前からありました。1993年に東京工業大学の坂田先生らはリチウム塩の溶液を使って、高圧の窒素存在下で電気分解を行うとアンモニアが生成することを発表しました[2]。それ以来リチウムを使った電気分解によるアンモニア合成の研究が世界中でなされています。電気分解の反応は以下の反応式に従って進みます。
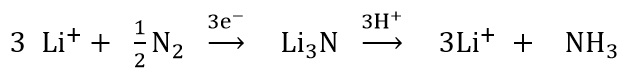
最初の段階で、窒素を還元して窒化リチウムを生成する時に電気を必要とするのです。窒化リチウムができれば、水素イオンと反応してアンモニアが生成します。水素イオンは水またはアルコールなどの化合物から供給されます。窒化リチウムが分解するときにリチウムイオンがまた生成するので、結局リチウムイオンは繰り返して使うことができ、触媒として働くことになります。
本年になって、オーストラリアの研究者が、電流効率ほぼ100%でアンモニアを窒素N2から合成できるという結果を発表しました。ここでいう電流効率とは、上の反応式、つまり3個の電子によって1個の窒化リチウム分子ができてそこからアンモニアが1分子できる反応が完全に理屈通りに進む場合100%の効率と定義されるものです。近年の研究で、この電気化学反応で重要なのは電気化学反応の際に添加する電解質であることが分かってきています。例えば水の電気分解をするときに、純粋な水ではなく、希硫酸をよく使うことは高校でも習ったことと思います。そのような電解質を添加することで、電極表面での反応がスムーズに進むようになるのです。またこの反応ではリチウムイオンLi+が必要なので、リチウム塩を添加することは必要です。陽イオンであるリチウムイオンと組み合わせる陰イオンも重要な要素です。この電気化学反応は有機溶媒中で行われることが多いので、有機溶媒でも溶ける塩の成分である、過塩素酸イオン(ClO4−)、テトラフルオロホウ酸イオン(BF4−)、トリフルオロメタンスルホン酸イオン(CF3SO3−)などがよく使われてきました。オーストラリア、モナシュ大学のMacFalaneとSimonovらのグループはこの反応を効率よく進行させるために、主にNTf2−(図1)という陰イオンを検討しました[3]。
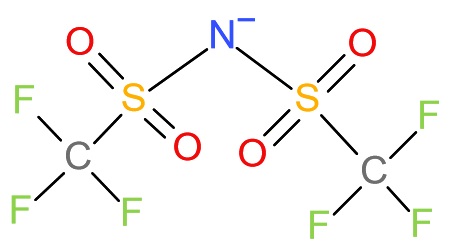 図1 NTf2-陰イオン(ビス(トリフルオロメチルスルホニル)イミドイオン)の構造。Tf2N-と書かれることもある。
図1 NTf2-陰イオン(ビス(トリフルオロメチルスルホニル)イミドイオン)の構造。Tf2N-と書かれることもある。
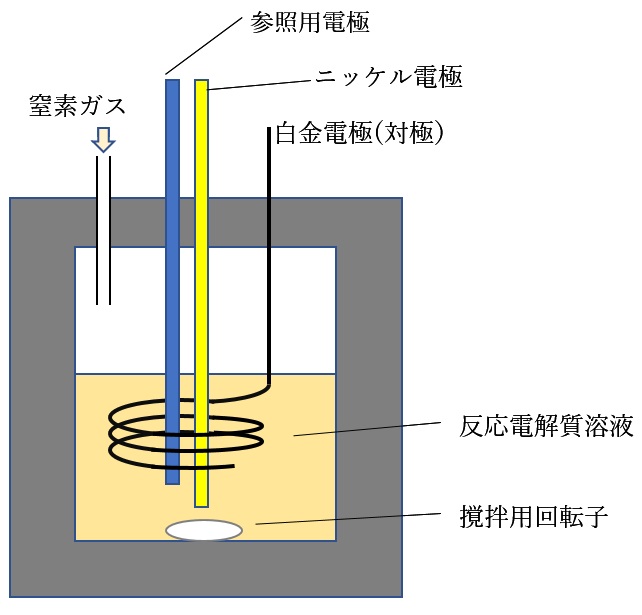 図2 電気化学反応容器 丈夫な合成樹脂製の容器内で窒素ガスの圧力をかけ、ニッケル電極に負の電圧、白金電極に正の電圧をかけて電流を流して反応を進ませる。
図2 電気化学反応容器 丈夫な合成樹脂製の容器内で窒素ガスの圧力をかけ、ニッケル電極に負の電圧、白金電極に正の電圧をかけて電流を流して反応を進ませる。
この陰イオンを持つ塩LiNTf2を用いて、図2のような電気化学反応容器を用いて実験を行いました。窒素を約15気圧の圧力で導入し、テトラヒドロフランという有機溶媒を用い、LiNTf2を加えてアンモニアがどのように生成するかを研究しました。特にLiNTf2の濃度を様々に変化させたところ、濃度によって大きく反応の効率が変わること、特にかなり濃い濃度(1.5 mol/L程度)にすると、アンモニア生成の電流効率が90%程度まで上がることが分かったのです。また、電極の形状を工夫することで、さらに電流効率ほぼ100%を達成することができました。
さらに、水を溶媒に用いて窒素と水からアンモニアと酸素を合成することが究極的な目的で、そのための研究も進めていると著者らは言っています。冒頭にも述べたように、電気化学反応以外にも多くのアンモニア合成法が研究されています。100年間続いたハーバー法が終わりの時期を迎えるのもそう遠くないかもしれません。ではまた次回。
[1] https://www.aiche.org/resources/publications/cep/2016/september/introduction-ammonia-production 2022/10/1閲覧
[2] A. Tsuneto, A. Kudo and T. Sakata, Chem. Lett., 1993, 22, 851–854.
[3] H.-L. Du, M. Chatti, R. Hodgetts, P. V. Cherepanov, C. K. Nguyen, K. Matuszek, D. R. MacFarlane, and A. N. Simonov, Nature 2022, 609, 722-727. https://www.nature.com/articles/s41586-022-05108-y
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 大気圧でも安定なヘリウム化合物 - 2025年6月2日
- 高エントロピー化合物を簡単に作る方法 - 2025年5月12日
- ローマ時代の鉛公害 - 2025年4月7日