
元素記号Si、原子番号14の元素、ケイ素。地殻中には酸素を除いて1番多い元素であり自然界にたくさん存在する。石英、水晶などほとんどが二酸化ケイ素からなるものと、石綿、雲母、長石などのようにケイ素と他の金属元素の酸化物のケイ酸塩鉱物がある。ケイ酸塩鉱物の多くは (SiO4)4-の陰イオンと金属の小さな陽イオンとからなっていることが多い。その陰イオンではケイ素のまわりに4個の酸素が正四面体状に配置していて、 (SiO4)の 正四面体が結晶構造の基礎となっている。
ケイ素、といえばアメリカのシリコンバレーが有名だ。多数の半導体またはITに関する企業が集まっている。これも半導体の主原料がケイ素Siliconからできていることから名づけられた。ここには、アップル、Google、Facebook、Yahoo、Dropbox、Microsoftなど超有名な会社が名を連ねている。
わたしたちの日常生活におけるケイ素の活躍は計り知れない。ケイ素を多く含むガラスは建材や食器などいたるところにあるし、セメントやシリコーン樹脂(グリース、ゴムなどの材料)もケイ素の化合物からなる。そして当たり前に使っているスマートフォンやパソコンなど様々な精密機器の中には、半導体が使われていてケイ素はその材料として必須である。これらの半導体やエレクトロニクスを支えるケイ素の利用については、第二次世界大戦中のレーダー電波検知器としてのケイ素整流器の開発研究が礎となったと考えられていて、現在のエレクトロニクス時代を築いたといえる。
「ケイ素水」と呼ばれる健康または美容商品も売り出されている。効果はさておき、このような商品のおかげでケイ素の名前をよく耳にするようになっているかもしれない。自然界にはケイ素を身にまとった美しい生物がいる。珪藻類だ。珪藻類には、その形状が幾何学的に美しいものがいる(写真参照)。
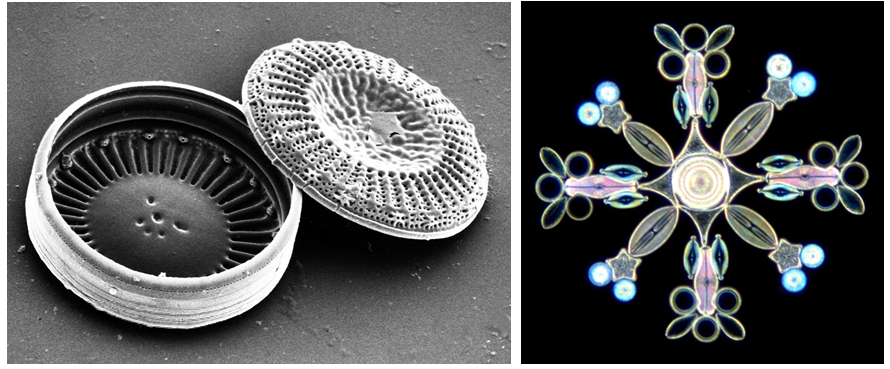
珪藻類の写真
左:番頭箱状(被殻)の個体を特製のブタのまつ毛の先端で殻の片方を開けて乾かし、走査型電子顕微鏡で観察したもの
右:偏光顕微鏡で観察すると珪藻の殻の構造によって偏光し、カラフルに見える
(写真の提供ご協力:越後自然誌研究所 南雲保博士)
写真の左のものは、宝箱のような形をした珪藻類で、写真撮影のためにあえて殻の上の片方を外したものだ。下の写真は偏光顕微鏡で撮影されたものである。これら珪藻類は珪藻土の元でもある。珪藻土は珪藻の遺体が海底や湖沼の底などに沈殿してできた堆積物であり、その主成分は二酸化珪素となる。珪藻土は古来日本の建材として使われ、その高い保温性と吸湿性を生かして壁土などに活用される。最近は天然志向の高まりでまた珪藻土がよく見直されるようになり、建材としてだけでなく、バスマット代わりの製品もよく売れている。
また食品でなじみのあるコメはイネからとれる。イネという植物は、なんとケイ素を乾燥重量の10%近くまで蓄積することができる。イネが台風などの激しい風雨にさらされても伐倒しない理由はケイ素による強靭な茎の構造による。またコメが堅いもみ殻に守られているのもケイ素のおかげである。しかし、植物が根から水とともにいかにケイ素を吸い上げ、蓄積できるかというメカニズムはまだ完全に解明されていない。土壌水中のケイ酸またはオルトケイ酸(n-H4SiO4)の濃度は0.1~0.6 mMという非常に希薄である。根の細胞膜で特異的なトランスポーターによる能動輸送を用いることで吸収量を調節していることが研究者らによって報告されている。
 稲穂の写真
稲穂の写真
実験1 水ガラスから乾燥用シリカゲルをつくる
ケイ酸ナトリウムNa2SiO3 8.0gに対して純水60 mLをビーカーに入れて攪拌しながら、ガスバーナー(弱い炎)で加熱する。溶液が透明で均一になったら加熱をやめる。得られたケイ酸ナトリウムの水溶液がいわゆる水ガラスである。これを少し冷ましてから、pH指示薬のフェノールフタレインを1~2滴入れる(ケイ酸ナトリウム水溶液はアルカリ性なのでピンク色になる)。2 mol/L塩酸を少しずつ加えていくと(15 mL程度)、ゲル化が進行して溶液が白濁してくるので、そのタイミングで塩酸を加えるのをやめる。少し待つとゲル化がさらに進む。ガラス棒でよく攪拌してから、60℃の乾燥機に入れて2日間ほど乾燥する。乾燥して固化したものを乳鉢で砕いて蒸発皿に入れる。水分が残っている場合にはさらにガスバーナーなどで加熱して水分をさらに除去すると乾燥用のシリカゲルが出来上がる。
 水ガラスがゲル化した様子
水ガラスがゲル化した様子
左:フェノールフタレイン滴下 右:塩化コバルト(Ⅱ)添加
 乾燥後の様子
乾燥後の様子
この水ガラスの反応は、ケイ酸ナトリウムが水和し、強酸の作用によりシラノール基(-SiOH)どうしの脱水縮合反応により、-Si-O-Si-の鎖がつくられてゲル化が起こるものである。この反応では脱水縮合によって水分子が抜けていくため、―Si-O-Si―の網目構造のあちこちにミクロな細孔が形成され、多孔質化が進む。また部分的にーSiOHが残っているのもシリカゲルの特徴である。
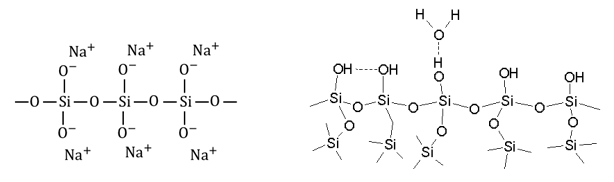 ケイ酸ナトリウム(左)と脱水縮合によって網目構造になったシリカゲル(右)のイメージ
ケイ酸ナトリウム(左)と脱水縮合によって網目構造になったシリカゲル(右)のイメージ
シリカゲル中のたくさんの細孔がその吸着能に影響しているが、それに加えて残存するシラノール基-SiOHと、水分子やアンモニア分子が水素結合を形成することも、脱水や脱臭などの吸着を促進する。市販のシリカゲルのように吸湿時にピンク、乾燥時にブルーを示すようにしたい場合には、最初の水ガラスをつくる段階で0.1 mol/L塩化コバルト(Ⅱ) を10 mL程度を加えるとよい。この際は塩化コバルト水溶液の添加ですでにゲル化が進むため、添加する塩酸の量は少なくてよい。
実験2 マシュマロゲルの作り方
近年注目を浴び始めたマシュマロゲル。このゲルは写真のようにふわふわとしていて、その柔軟性が液体窒素のような極低温でも保たれるほど、その温度域が広い。
そしてマシュマロゲルは超撥水性と特定の油を吸い取るなどの分離能がある。スポンジのように多孔体だがこのゲルは内部の90%以上が細孔である。そのスペースに油だけを吸い込み絞り出すことができるので、石油流出事故などにおいて油/水分離媒体として使うこともできるだろう。このマシュマロゲルの作製は簡単、なのだそうだ。マシュマロゲルを開発した研究者本人にレシピを紹介していただいた。
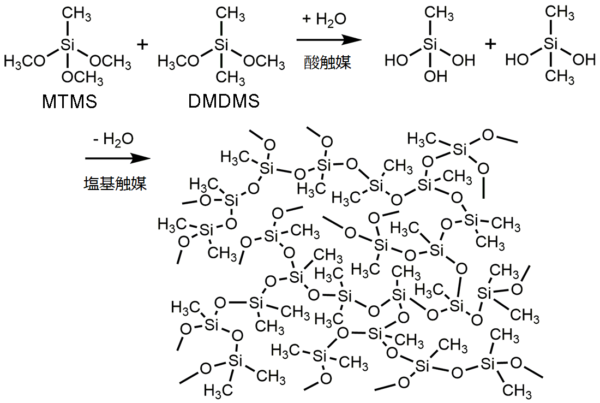
①界面活性剤の塩化n-ヘキサデシルトリメチルアンモニウム (CTAC) 1 g を溶解した5 mM 酢酸水溶液14 mL に,前駆体メチルトリメトキシシラン(MTMS)3 mL およびジメチルジメトキシシラン (DMDMS)2 mL を加えて数分間攪拌する。
② 500 mM アンモニア水1 mL を加えて1 分間攪拌し、型に流して静置する。3 分間程度で系全体がゲル化する。
③ アルコールや水に浸漬して界面活性剤などを洗い流したのち、自然乾燥して目的物を得る。
 マシュマロゲルを握った様子
マシュマロゲルを握った様子
 様々な溶媒をはじく様子
様々な溶媒をはじく様子
左上から右下へ:n-ヘキサデカン、ジヨードメタン、1-ブロモナフタレン、ホルムアミド、エチレングリコール、水
マシュマロゲル作製時の反応
(写真および作製レシピ:東北大学(現 物質・材料研究機構)早瀬 元 提供)
マシュマロゲルの詳細はこちら
参考文献:
石澤秀紘・北島薫、「植物によるケイ素利用の謎」、生物工学会誌 第95巻 第1号、p.20(2017)
山地直樹・馬建鋒、「イネのケイ酸吸収機構」化学と生物『バイオミディア』、vol.44, No.7 (2006)
米沢剛至、「水ガラスからシリカゲルをつくる実験(私のくふう)」、化学と教育、51巻12号、p. 788-789(2003)
山﨑 友紀
最新記事 by 山﨑 友紀 (全て見る)
- 実験講座 番外編 アメリカ、サンフランシスコ湾での天然塩づくり - 2024年3月25日
- 実験講座 番外編 アメリカ カリフォルニアで見た多様な鳥たち - 2024年1月29日
- 実験講座 番外編 アメリカCalifornia Academy of Science(科学博物館)訪問 - 2023年11月27日