
ダメな空気と言われている?!
第三回は、原子番号7「窒素」のお話です。
地球大気は、体積比にして78%の窒素分子(N2)と21%の酸素分子(O2)からできています。この世界には118の元素が存在しているのに 、たった2種類のガスで地球大気の約99%が占められているとは、ちょっとした驚きです。魚は水(H2O)の中を泳いでいて、私たちは酸素の混ざった窒素の中で暮らしているのです。
ところが私のこのイメージとは逆に、窒素は、フランスなどでは、“生命が存在できない物質”を意味する「azote(アゾート)」と呼ばれています。その日本語訳が“窒息させる物質・窒素”です。(英語は、硝石から生じるという意味でNitrogen)
こんな穏やかでない名前を付けられてしまったのには、窒素の発見の経緯が関わっています。誰が最初に見つけたとするかは幾つか説がありますが、もっとも有力なのは、1772年にイギリスのラザフォードが発見したとするものです。
ラザフォードは、まず、密閉した容器の中でろうそくを燃やして、酸素を二酸化炭素にしました。この気体をアルカリ液で処理して二酸化炭素を除くと、後に気体が残ったのです。ラザフォードは、地球大気が1種類の気体でできているのではないことを知りました。この気体は、大気から酸素を除いた後に残る窒素でした。酸素がないので、生物は生きられませんし、ろうそくも燃えません。このため“ダメな空気”と呼ばれてしまったのです。
生物の身体をつくり、遺伝に関わる
“ダメな空気”、“生命が存在できない物質 ”などと散々な言われ方です。確かに、窒素分子はとても安定で、あまり反応を起こしませんから、こういった印象を持たれてしまったのも無理はないかもしれません。しかし窒素は生命にとってなくてはならない元素です。
例えば、生物の身体は、アミノ酸がつながったタンパク質できています。アミノ酸は、図1のようにアミノ基とカルボキシ基を持つ化合物で、必ず窒素を含んでいます。ほかにも遺伝情報を担うDNAには窒素が含まれています。
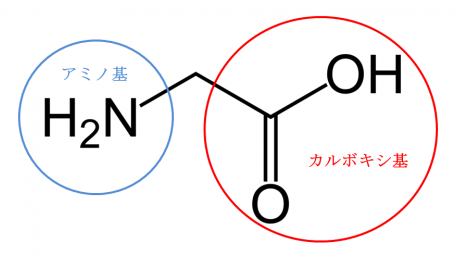
(図1)最も構造が単純なアミノ酸、グリシンの構造式
だから窒素は大気中にたくさんある・・・・と話を続けたいところですが、地球はそれほど生物に都合よくできてはいません。動物は食べ物からしか窒素を摂り込むことができません。植物は、根から水と栄養分を吸収して光合成によって成長します。この栄養分に窒素が含まれていますが、土壌に豊富にあるわけではないので、植物を育て続けるとすぐに足りなくなり、成長は悪くなります。
つまり、窒素は大気中に78%もありながら、動物や植物にとって容易に取り込むことのできないといった意味からも貴重な元素なのです。
自然界では簡単に作り出せない窒素化合物
大気中に78%もあるのに、足りなくなるとはどういうことでしょうか(図2) 。元素はその組み合わせによって、さまざまな物質を作ります。その中には安定なものと不安定なものがあり、通常は、安定なものしか存在しません。そして、それが大気中にあるのがいいのか、土壌中がいいのか、それとも水中なのかによって、地球上での分布が決まっています。
 (図2)窒素サイクル。窒素元素は、火山は大量の窒素を噴き上げる。雷の放電によって、窒素原子と酸素原子からなる窒素酸化物ができる。窒素酸化物は雨に溶けて土壌に降り注ぐ。また、生物が死ぬと細菌の分解を受けて、アンモニアやアミドといった窒素化合物を生じる。このような窒素源を植物は成長のために使い、動物はその食料から窒素を摂取している。動物も植物も成長のために窒素が必要だが、気体の窒素を分解して利用することはできない。例外的に、豆科の植物の中に、根粒菌との共生によって窒素を得ているものがある(提供:depositphotos)。
(図2)窒素サイクル。窒素元素は、火山は大量の窒素を噴き上げる。雷の放電によって、窒素原子と酸素原子からなる窒素酸化物ができる。窒素酸化物は雨に溶けて土壌に降り注ぐ。また、生物が死ぬと細菌の分解を受けて、アンモニアやアミドといった窒素化合物を生じる。このような窒素源を植物は成長のために使い、動物はその食料から窒素を摂取している。動物も植物も成長のために窒素が必要だが、気体の窒素を分解して利用することはできない。例外的に、豆科の植物の中に、根粒菌との共生によって窒素を得ているものがある(提供:depositphotos)。
窒素分子の場合、窒素原子と窒素原子の間にある三重結合が強いので(N≡N)、とても安定で大気中にたくさん存在しています。しかしこの三重結合が簡単に切れないために、たくさんある窒素分子の中の窒素原子を、誰も利用できないのです。
ごく稀に、この三重結合を切るものがあります。それが雷と一部の微生物です。雷の放電のエネルギーによって、窒素分子の三重結合が切れ、窒素元素は酸素元素と結びつき窒素酸化物(NOx)になります。これが雨に溶けて、硝酸や亜硝酸として土壌に降り注ぎます。
大豆などマメ科植物の根には数mmの瘤(ルビ:こぶ)のようなものがたくさん付いています。この中には、根粒菌という土壌微生物が住んでいて、大気中の窒素をアンモニアに変換しています。
植物は、硝酸や亜硝酸、アンモニアに含まれる窒素なら利用できます。雷を人工的に落とすことはできませんが、農作物を大豆と交互に栽培すれば窒素不足を防ぐことができます。
大気中の窒素を使えるようにした「ハーバー・ボッシュ法」
植物に、窒素やほかの栄養分を供給するのが肥料です。家畜の糞や、落ち葉を腐らせた堆肥などは、生物由来の窒素を含んでおり、古くから肥料として使われてきました。そして現在は、肥料を工業的に作れるようになっています。ドイツのハーバーとボッシュが、大気中にある窒素分子をアンモニアにする方法を発明し、1913年に実用化に成功したからです。
窒素分子の三重結合を切れる大きなエネルギーを得るには、高温高圧の条件でなければなりません。ハーバー・ボッシュ法では鉄系の触媒を使うことで、500℃、1000気圧程度の条件で合成できるようになりました。これでも高温高圧じゃないかと思われるかもしれませんが、ここまで下げられたので、温度と圧力に耐えられる工場や反応容器をつくれたのです。それでも合成コストはかなりかかるので、温度と圧力を下げるための研究が今も続けられています。
こうしてつくられたアンモニアは肥料になるほかに、染料や樹脂、医薬品の製造に使われています。窒素は、生物の成長から化学工業に至るまで、今回だけでは語りつくせないほど、広く活躍している元素なのです。
次回も引き続き窒素について、その化学工業での重要性を紹介します。
参考資料
『元素の事典』朝倉書店、2003
『窒素の物語』大月書店、2006
Leading Author’s:http://leading.lifesciencedb.jp/4-e010/
『根粒菌ってすごい!!』(秋田県立大学):https://www.akita-pu.ac.jp/columnitem.htm?serial_no=105
池田亜希子
最新記事 by 池田亜希子 (全て見る)
- 人間がつくった元素たちは、生活の中にあるの? - 2019年11月18日
- 周期表にない!? 最近、問題のトリチウムって何?(T、原子番号1) - 2019年10月14日
- 柔らかくて使いやすい、この金属にはご用心 鉛(Pb、原子番号82) - 2019年9月16日