おとなしい窒素が大活躍!!
第四回は、前回に続いて原子番号7「窒素」のお話です。
窒素ガス(窒素分子、N2)は、体積比にして地球大気の78%を占めます。これほどたくさんある窒素ガスですが、窒素原子と窒素原子の間にある三重結合(N≡N)が強いために、常温では、ほかの物質と反応しにくく不活性な気体だと前回紹介しました。
「不活=活発でない」と言われると、私には何だが残念に感じられてしまいますが、同じことを「安定」と言い換えれば、一転、いいことのようです。実際に、窒素ガスが安定(不活性)であることは、とても重要なのです。
まず、私たちが安心して暮らせるのは、身の回りの窒素ガスが安定だからです。また、ポテトチップスの袋や飲み物の缶には窒素ガスが封入されているのは、食品が酸素と反応して味や匂いが悪くなるのを防ぐためだということは、多くの人が知っているでしょう(図1)。
この窒素ガスの“環境を不活性な雰囲気にする”性質は、半導体をつくる際の酸化防止や、燃えたり爆発したりする危険性のある原料を扱う化学工場や石油コンビナートでの爆発防止のためにも役立っています。また、空気の温度を下げることで取り出される液体窒素は、-196 ℃と極低温なので冷却材として使われています。
 (図1)おとなしい窒素が活躍するところ(提供:depositphotos)
(図1)おとなしい窒素が活躍するところ(提供:depositphotos)
一転、暴れん坊の顔に
こうして見ると、窒素分子はその安定した(おとなしい)性質故に、大活躍しているのがわかります。だからといって窒素原子をおとなしい元素だと決め付けてはいけません。結合する相手の元素が変わってくると、一転、とても激しい一面を見せるのです。そのことを、『窒素の物語』の中で、著者のカレン・フィッツジェラルドは“かんしゃく持ち”と言っています。
花火を打ち上げたりするのに使われる火薬は、75%が硝石(硝酸カリウム、KNO3)、15%が炭素(C)、10%が硫黄(S)でできています(図2)。この成分比率は、火薬の威力を高めるために、調合を繰り返して決められました。火薬が起こす爆発の威力が炭素や硫黄ではなく、硝石によるものだというのは、そのメカニズムを考えるとわかります。
硝石の中の窒素原子と酸素原子の結合はあまり安定ではありません。カレン・フィッツジェラルドに言わせると、“仲良くない”ということです。点火されると、酸素原子はここぞとばかりに窒素原子と離れ、そこにある炭素原子と結合して二酸化炭素(CO2)に、硫黄原子と結合して二酸化硫黄(SO2)になります。残された窒素原子は、窒素原子どうしで結合します。このいろいろな結合反応が非常に短時間に起こるので、大きな熱が一気に発生します。その結果、二酸化炭素、二酸化硫黄、窒素ガスが混ざった高温の気体が勢いよく吹き出すのです。これが火薬の爆発です。
 (図2):花火を打ち上げる火薬の爆発現象は窒素原子を含む硝石が起こしている(提供:depositphotos)
(図2):花火を打ち上げる火薬の爆発現象は窒素原子を含む硝石が起こしている(提供:depositphotos)
爆発するのは火薬だけではありません。もっと強力な窒素爆薬がいくつも発見されています。ニトログリセリンも、トリニトロトルエン(TNT)もニトロ基(-NO2)を3カ所もっています。窒素原子と酸素原子の仲の悪い結合が多いほど、爆発の威力は大きいのです。
ちなみに、ノーベルの発明したダイナマイトは、液体であるニトログリセリンを固い物質に染み込ませた爆薬です。こうすることで、爆発しやすくて危険だったニトログリセリンは、比較的安全に取り扱えるようになりました。また、ニトログリセリンは狭心症の特効薬でもあります。爆薬が薬なのかと驚きですが、薬として投与されるニトログリセリンの量はごく僅かなので、薬を間違って噛み砕いたり床に落としたりしても爆発する心配はありませんので、ご安心を。
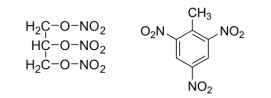 (図3)ニトログリセリン(左)とトリニトロトルエン(右)。どちらもニトロ基(-NO2)をたくさん持っている。
(図3)ニトログリセリン(左)とトリニトロトルエン(右)。どちらもニトロ基(-NO2)をたくさん持っている。
染料や繊維にも窒素元素
化合物を発色させるのも、窒素原子の得意技です。私たちの生活を豊かにした化学工業の始まりは、染料の合成だと言われます。1856年にイギリスのW.H.パーキンが発見したモーブ (紫色)が世界で最初の合成染料ですが、窒素原子を含んでいます(図4-1、2)。その後、さまざまな染料が発明されており、その中には窒素原子を含まないものもあります。しかし、合成染料の半分以上を占めているとも言われるアゾ染料は、アゾ基(-N=N-)を共通にもっているので、窒素原子を発色が得意な元素と言ってよさそうです。

(図4-1)パーキンの息子からの手紙。モーブで染められた絹が同封されている(Henry Rzepa氏による“A photograph of the letter from Perkin’s son, with a sample of dyed silk”ライセンスはCC 表示-継承 2.5に基づく)
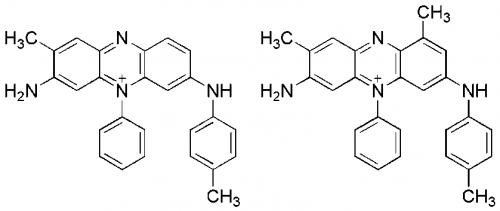 (図4-2)モーブを構成する色素モーベインは主に2種類の色素モーベインA(左)とモーベインB(右)の混合物
(図4-2)モーブを構成する色素モーベインは主に2種類の色素モーベインA(左)とモーベインB(右)の混合物
もう窒素の話はお腹いっぱいだと思うので、「窒素原子を含む化合物の中には、薬やプラスチックをつくる際の中間体として重要なものがある」という話で終わりにしましょう。ABS(アクリロニトリル-ブタジエン-スチレン)樹脂は(図4)、その名の通りアクリロニトリル、ブタジエン、ポリスチレンの3つの成分からできたプラスチックで、これらの成分の長所が活かされています。3つの成分の配合率を変化させたり、そのほかの成分を加えたりして、強力なABS樹脂や、特別な性能を備えたABS樹脂をつくり出すことができるので、自動車や家電製品、住宅用建材、家庭用品とあらゆるものに使われています。
その合成に必要な中間体のアクリロニトリルは、工業的に非常に重要な窒素化合物の1つで、大量に生産されています。また、このアクリロニトリルをつくるのには、ハーバー・ボッシュ法でつくられたアンモニアが原料として使われています(第三回参照)。
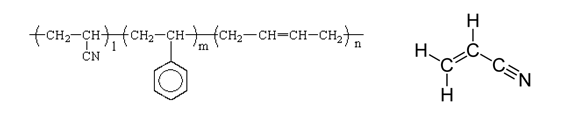 (図4):ABS樹脂(左)とその中間体のアクリロニトリル(右)。アクリロニトリルを含む3つの成分の比率を変える(l、m、nの数字が変わる)ことで、ABS樹脂はさまざまな性質を示す。
(図4):ABS樹脂(左)とその中間体のアクリロニトリル(右)。アクリロニトリルを含む3つの成分の比率を変える(l、m、nの数字が変わる)ことで、ABS樹脂はさまざまな性質を示す。
窒素元素を考える
ここまで2回にわたって窒素原子を紹介してきました。窒素は良い奴なのか悪い奴なのか。これほどいろいろな顔を持つ元素もなかなかないように思います。前半で、人類が空気中の窒素を使ってアンモニアをつくれるようになったと紹介しました。これにより窒素肥料がつくられるようになり農業生産性は上がりました。このことが、地球の人口をここまで増やしました。しかし、これも度を過ぎれば、植物が生長しすぎて死んだり、窒素肥料が湖に流れ込み富栄養を起こしたりします。
また、最近はいろいろな対策が取れるようになってはいますが、酸性雨の原因のNOx(ノックス)は、火力発電所やガソリン自動車の排ガスやから出される窒素酸化物です。いろいろな顔を持つ窒素という元素との付き合い方はなかなか難しそうです。
参考資料
『元素の事典』朝倉書店、2003
『窒素の物語』大月書店、2006
カルビー:http://faq.calbee.co.jp/faq_detail.html?page=500&id=69
エア・ウォーター株式会:http://www.awi.co.jp/business/industrial/gas/n2.html
火薬の原理:https://pub.nikkan.co.jp/uploads/book/pdf_file51f62d2f24245.pdf
環境再生保全機構:https://www.erca.go.jp/yobou/taiki/kids/aozora/haisyutu_04.html
日本心臓財団:http://www.jhf.or.jp/bunko/mimiyori/02.html
化学はじめて物語:http://www.nikkakyo.org/upload/plcenter/349_371.pdf
プラスチック素材事典:http://www.plastics-material.com/abs/
株式会社アイ・メーカー:https://i-maker.jp/blog/abs-5282.html
池田亜希子
最新記事 by 池田亜希子 (全て見る)
- 人間がつくった元素たちは、生活の中にあるの? - 2019年11月18日
- 周期表にない!? 最近、問題のトリチウムって何?(T、原子番号1) - 2019年10月14日
- 柔らかくて使いやすい、この金属にはご用心 鉛(Pb、原子番号82) - 2019年9月16日
