アンモニアは、肥料や薬品をはじめとする多くの化学製品の原料としてきわめて重要な物質です。アンモニアは、工業的には空気中の窒素と、水素(現在は主に石油や天然ガスの分解によって得られる)から作られています。基本的には100年以上前に発明されたハーバー法(ハーバー・ボッシュ法)が現在も利用されています。この方法は鉄を主体とする触媒を用いて反応を行うもので、従来は、400℃以上の高温、そして100気圧以上の高圧条件で反応を行っており、製造には大きなエネルギーを必要とします。もっと温和な条件でアンモニアを作る研究は以前よりさかんに行われており、私のブログでも既に2回(窒素と水からアンモニアを合成する方法と電気でアンモニアを作る方法 )取り上げています。ごく最近も日本人化学者によりアンモニア合成の新たな方向を示す大きな発見が相次いでおり、今回はそれらから2つの成果を紹介しましょう。
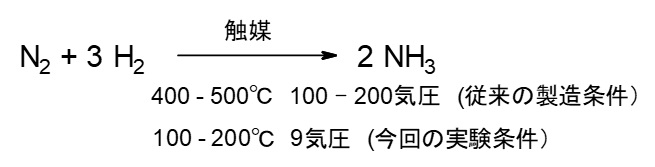 アンモニア合成の基本的な化学反応式
アンモニア合成の基本的な化学反応式
ハーバー法は、鉄を主体とする固体を触媒として、その表面で窒素と水素が反応してアンモニアが生成します。近年では鉄以外にルテニウム、コバルトなど様々な金属を触媒に用いる研究が行われてきました。それらの中には100-200℃という比較的低温でも働く触媒も見いだされています。しかし、思ったほど反応が進まないなどの欠点も有していたのです。東京工業大学の原亨和(はらみちかず)教授らは、従来用いられてきた鉄触媒に、水素化バリウムを添加するという方法によって、従来と同じ鉄を主体としながらも、比較的低温でも速い速度で反応を進めることができる触媒を開発することに成功しました[1]。
窒素分子の窒素原子間の結合はきわめて丈夫で切りにくいことが知られており、これが窒素分子が反応しにくい原因です。ハーバー法では、まず触媒表面に窒素分子(N2)がぶつかると窒素原子間の結合が切れて、窒素原子が触媒の表面で生成します。また、水素分子も同様に分解され、水素原子が触媒表面で生成します。こうして生成した窒素原子と水素原子が触媒表面で結合してアンモニア分子となって触媒から離れていくのです(図1a)。鉄よりもルテニウム(Ru)などの他の金属の方が、窒素分子の切断という点に関しては優れていました。しかしルテニウムなどの金属はその表面に水素原子が強く吸着して離れにくいという性質を持っています。すると水素分子から生成した水素原子が触媒の表面を覆ってしまい、窒素分子が反応できなくなってしまうのです(図1b)。これを水素被毒といいます。これに対して鉄表面では、水素原子がまた2個合体して水素分子となる性質が比較的強いために、水素被毒は起こりません。鉄触媒表面では窒素分子の反応が起こりにくいという欠点を克服するために、今回カルシウムとバリウムの水素化物(CaH2とBaH2)を加えることが考えられました。 鉄近傍のBaH2から電子が放出され、鉄はこの電子の力を借りて、窒素を素早く反応させることができるようになりました。このようにして新たに作られた鉄触媒を用いると、100℃程度の低温でも、非常に速い反応速度でアンモニアが生成することが分かりました。
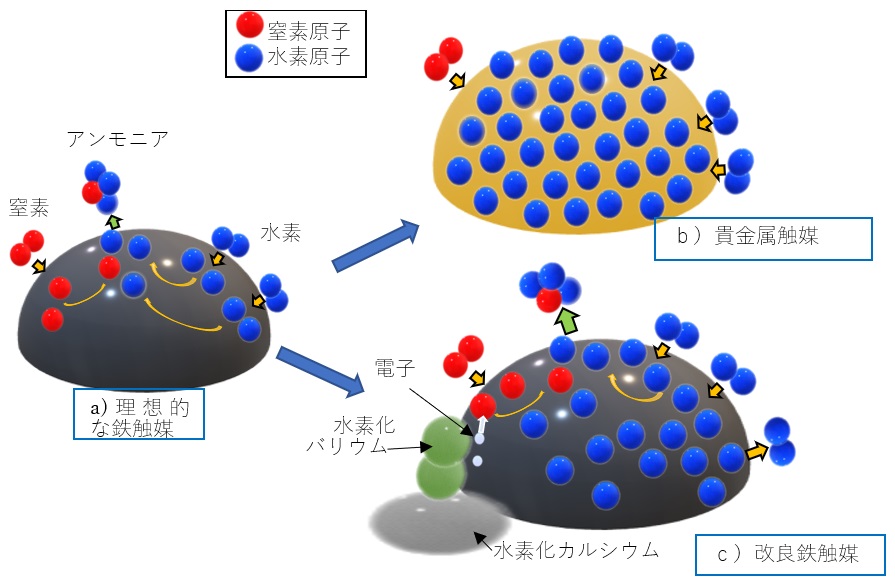 図1 a) 理想的な鉄触媒。窒素分子と水素分子が触媒の表面でそれぞれ原子状態となり、それらが移動して合体し、アンモニアとなる。b) ルテニウムなどの貴金属触媒。水素分子が触媒表面で水素原子となり、それらがたまっていって触媒表面を覆ってしまい(水素被毒)、窒素が反応する場所がなくなってしまう。c) 改良鉄触媒では水素化カルシウムと水素化バリウムの働きにより、窒素分子が反応する。鉄表面でも水素分子から水素原子が生成するが、元の水素分子に戻る反応もある程度の速さで進行するために水素被毒は起こらない。
図1 a) 理想的な鉄触媒。窒素分子と水素分子が触媒の表面でそれぞれ原子状態となり、それらが移動して合体し、アンモニアとなる。b) ルテニウムなどの貴金属触媒。水素分子が触媒表面で水素原子となり、それらがたまっていって触媒表面を覆ってしまい(水素被毒)、窒素が反応する場所がなくなってしまう。c) 改良鉄触媒では水素化カルシウムと水素化バリウムの働きにより、窒素分子が反応する。鉄表面でも水素分子から水素原子が生成するが、元の水素分子に戻る反応もある程度の速さで進行するために水素被毒は起こらない。
今回紹介したいもう1つの研究成果は、光のエネルギーを利用してアンモニアを合成する反応です。以前東京大学の西林仁昭(にしばやしよしあき)先生の研究室で、モリブデン触媒を用いて、窒素と水からアンモニアを合成したという研究を紹介しました。西林先生はその反応の効率を上げる研究も精力的に行っておられますが[2]、昨年末にはモリブデン触媒と共にイリジウムという金属の触媒を用い、光をあてることで、窒素分子からアンモニアを合成することができることを示しました[3]。この反応では水素を加える代わりにアクリジンという物質を加えており、これが水素原子を供給する(還元剤となる)ことでアンモニアが生成します。図2に示すモリブデン(Mo)を含む化合物とイリジウム(Ir)を含む化合物を使って、1気圧の窒素ガス下で可視光を当てることで、最大50%の収率でアンモニアが得られることが分かりました。イリジウム化合物が光のエネルギーを吸収し、アクリジンが反応しやすいようにしていると考えられています。光を当てないとこの反応は進まず、光のエネルギーをアンモニア合成に利用していることも確認されました。
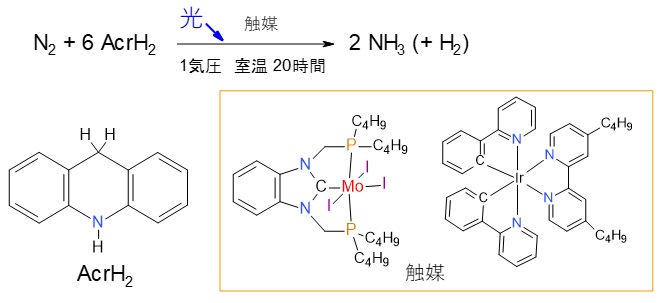 図2 光を用いて窒素とアクリジンからアンモニアを合成する。AcrH2はアクリジンを表す。オレンジ色の枠内に示しているのか、今回の研究で用いられたモリブデン(Mo)とイリジウム(Ir)化合物。
図2 光を用いて窒素とアクリジンからアンモニアを合成する。AcrH2はアクリジンを表す。オレンジ色の枠内に示しているのか、今回の研究で用いられたモリブデン(Mo)とイリジウム(Ir)化合物。
ハーバー法の改良は比較的すぐにでも実用化可能かもしれません。また、2番目に紹介したような、1気圧の窒素を利用する様々な反応は、実用という観点では乗り越えるべきハードルはまだまだ高いですが、最も困難とみられていた窒素分子の反応は解決策が見えてきたという状況にあります。窒素分子の反応の研究には、日本の研究者たちが長年努力をされてこられ、それが素晴らしい成果に結びついているように思います。ではまた次回。
[1] M. Hattori, N. Okuyama, H. Kurosawa and M. Hara, J. Am. Chem. Soc., 2023, 145, 7888–7897. 東工大のサイトにはこの研究内容の紹介やアンモニア合成に関する解説があります。(2023年4月30日閲覧)
https://www.titech.ac.jp/news/2023/066470
https://www.titech.ac.jp/public-relations/about/stories/ammonia-synthesis
[2] Y. Ashida, T. Mizushima, K. Arashiba, A. Egi, H. Tanaka, K. Yoshizawa and Y. Nishibayashi, Nat. Synth., 2023, 1–10.
[3] Y. Ashida, Y. Onozuka, K. Arashiba, A. Konomi, H. Tanaka, S. Kuriyama, Y. Yamazaki, K. Yoshizawa and Y. Nishibayashi, Nat. Commun., 2022, 13, 7263.
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 新たな生体埋め込み型電池の開発 - 2024年7月22日
- 二酸化炭素排出ゼロを目指す製鉄方法 - 2024年6月10日
- 都市鉱山からの低コスト高効率金回収 - 2024年5月13日